委員會紀錄
立法院第9屆第1會期社會福利及衛生環境委員會第13次全體委員會議紀錄
時 間 中華民國105年4月7日(星期四)9時至14時48分
地 點 本院群賢樓801會議室
主 席 王委員育敏
主席:出席委員已足法定人數,現在開會。進行報告事項。
報 告 事 項
一、宣讀上次會議議事錄。
立法院第9屆第1會期社會福利及衛生環境委員會第12次全體委員會議議事錄
時 間:105年4月6日(星期三)9時2分至12時25分
14時35分至16時36分
地 點:本院群賢樓801會議室
出席委員:劉建國 吳焜裕 鍾孔炤 洪慈庸 吳玉琴 陳宜民 蔣萬安 陳曼麗 陳 瑩 李彥秀 王育敏 黃秀芳 林靜儀 林淑芬 楊 曜
(委員出席15人)
列席委員:吳秉叡 鍾佳濱 柯志恩 盧秀燕 李昆澤 徐永明 鄭天財
高潞‧以用‧巴魕剌Kawlo.Iyun.Pacidal 黃偉哲 陳歐珀 管碧玲 江啟臣 鄭運鵬 蕭美琴 廖國棟 林麗蟬 賴士葆 王惠美 陳怡潔 陳亭妃 張麗善 林俊憲 賴瑞隆 邱志偉 簡東明 高金素梅 呂玉玲 許毓仁 姚文智 顏寬恒 尤美女 陳賴素美 黃昭順 周陳秀霞
(委員列席34人)
|
列席官員:
|
衛生福利部
|
部長
|
蔣丙煌
|
|
醫事司
|
司長
|
王宗曦
|
|
保護服務司
|
司長
|
張秀鴛
|
|
心理及口腔健康司
|
司長
|
諶立中
|
|
社會救助及社工司
|
司長
|
李美珍
|
|
社會及家庭署
|
副署長
|
祝健芳
|
|
疾病管制署
|
副署長
|
周志浩
|
|
中央健康保險署(上午)
|
副署長
|
蔡淑鈴
|
|
中央健康保險署(下午)
|
主任秘書
|
沈茂庭
|
|
國民健康署
|
組長
|
林莉茹
|
|
食品藥物管理署
|
副組長
|
劉淑芬
|
|
附屬醫療及社會福利機構管理會
|
執行長
|
林慶豐
|
|
內政部警政署
|
副署長
|
陳嘉昌
|
|
刑事警察局
|
副局長
|
呂春長
|
|
警政署防治組
|
代理組長
|
侯木川
|
|
法務部保護司
|
司長
|
游明仁
|
|
教育部
|
次長
|
林思伶
|
|
學務特教司
|
司長
|
劉仲成
|
|
終身教育司
|
司長
|
黃月麗
|
|
國民及學前教育署
|
副署長
|
王承先
|
|
國家通訊傳播委員會
|
代理副處長
|
吳 娟
|
主 席:王召集委員育敏
專門委員:趙弘靜
主任秘書:劉錦章
記 錄:簡任秘書 黃淑敏
研 究 員 鄭翔勻
簡任編審 黃維郎
科 長 葉淑婷
專 員 江建逸
報 告 事 項
一、宣讀上次會議議事錄。
決定:議事錄確定。
二、衛生福利部、內政部、法務部、教育部、國家通訊傳播委員會就「從校園及社區安全維護、毒品防制、藥酒癮戒治、充實精神醫療體系、兒童人身安全及家庭教育、媒體自律報導、建立高危險群預警篩檢關懷機制,探究殺童悲劇之防治對策及相關修法規劃」列席報告,並備質詢。
(本次會議由衛生福利部蔣部長丙煌、內政部警政署陳副署長嘉昌、教育部林次長思伶、法務部游司長明仁及國家通訊傳播委員會吳代理副處長娟列席報告並備詢。委員劉建國、洪慈庸、吳玉琴、吳焜裕、陳宜民、鍾孔炤、陳曼麗、蔣萬安、陳瑩、李彥秀、王育敏、黃秀芳、林靜儀、楊曜、蕭美琴、柯志恩、鍾佳濱、林麗蟬、林淑芬及廖國棟等20人提出質詢,均經衛生福利部蔣部長丙煌暨各相關主管、內政部警政署陳副署長嘉昌、教育部林次長思伶暨各相關主管、法務部游司長明仁及國家通訊傳播委員會吳代理副處長娟等即席答復。)
決定:
一、本日會議報告及詢答完畢。
二、委員林俊憲、高潞‧以用‧巴魕剌Kawlo.Iyun.Pacidal、呂玉玲及李昆澤等所提書面質詢,列入紀錄刊登公報,並請相關機關書面答復。
三、委員口頭質詢未及答復或請補充資料者,請於2週內以書面答復,委員另要求期限者,從其所定。
通過臨時提案11案:
一、原健保署提出之105年度健保支付方案是將所有西醫支付標準統一提高11%,但今年二月份召開健保支付費用協商會議時,西醫所有各類支付標準均照案提高,唯該會最後以精神科慢性病房長期住院違反病患利益為由,將精神科慢性病房治療費提高項目排除,進而通過該議案。此舉已等於實質縮減精神科的住院醫療服務,也實質減損嚴重精神病患的應有治療,造成原應持續於住院環境中治療的嚴重精神病患過早的出院返回社區。目前討論擴大精神衛生法中緊急強制送醫的要件,然更重要的是送醫後繼續的適當治療才是整體政策可以有效果的關鍵。爰建請健保署研議未來爭取預算將精神科慢性病房治療費予以提高。
提案人:黃秀芳
連署人:陳曼麗 陳 瑩
二、鑒於根據《精神衛生法》第三十二條第一項,警察機關及消防機關對於該法第三條第一款所定狀態之人有傷害他人或自己或有傷害之虞者是否護送就醫,各縣市政府警察局、衛生局之認定標準不一。爰建請衛福部及內政部召集縣市政府衛生局、警政單位、消防單位檢討及釐清《精神衛生法》第三十二條第一項警察及消防機關護送就醫的疑慮;另衛福部應檢討根據該法第八條會同中央社政、勞工及教育主管機關建立社區照顧、支持與復健體系之成效及改善措施,並重新檢討《精神衛生法》所定精神疾病各情事所需之治療方式為精神醫療機構或社區治療為佳,於一個月內將相關結果送交立法院社會福利及衛生環境委員會。
提案人:黃秀芳
連署人:吳玉琴 陳曼麗 陳 瑩 尤美女
三、鑒於人格疾患並無身障手冊,除非透過導師轉介校園諮商或當事人有諮商意願,否則人格疾患在校園中難以被察覺。爰要求教育部二個月內針對校園中人格疾患學生之輔導諮商處理機制提出改善方案,並送交立法院社會福利及衛生環境委員會。
提案人:黃秀芳
連署人:吳玉琴 陳曼麗 陳 瑩 尤美女
四、鑒於目前校園霸凌事件常見之處理形式多為被害人因焦慮、退縮等情緒困擾,被導師轉介至諮商中心進行個別諮商,諮商中心僅進入班進行宣導,無法避免於特定班級暴露於霸凌者存在之環境,使之無法藉由完善之諮商提升心理健康素質。又校園中之霸凌者一般由教官等訓輔單位接手,多為威嚇處罰、記警告、小過,諮商輔導人員難以接觸到霸凌者;甚至在大專院校諮商乃尊重個人意願,即無強制性。
爰要求教育部於二個月內提出諮商輔導人員介入霸凌案件及修復式正義作法介入霸凌案件之改善機制,並送交立法院社會福利及衛生環境委員會。
提案人:黃秀芳
連署人:吳玉琴 陳曼麗 陳 瑩 尤美女
五、鑒於《精神衛生法》第42條強制就醫規定,自96年修正、97年施行以來,強制就醫人數自96年3,171件逐年下降,迄至104年僅剩634件。日前更因政大搖搖哥強制送醫事件,讓強制就醫引發社會極大的爭議,強制就醫人數減少的原因為何?強制就醫門檻有無調整之必要?強制就醫涉及拘束人身自由之強制處分,是否應交由法院做最後判斷?爰要求衛福部針對《精神衛生法》第42條以下關於強制就醫規定,提出檢討及修法報告研議方向,並於一個月內向立法院社會福利及衛生環境委員會報告。
提案人:蔣萬安
連署人:王育敏 陳宜民
六、鑒於《身心障礙者權益保障法》第50條、第51條規定,規定縣(市)主管機關應依評估結果辦理服務,提供身心障礙者(包含精障)獲得所需之個人支持與家庭照護。但實務運作上,精障者沒有辦法獲得這些照護,原因在於目前沒有照護精障者的專業訓練;又衛福部雖有補助各縣市政府衛生局聘任96名關懷訪視員,協助全國2,742名公共衛生護士共同提供14萬2,416名精神病患之社區追蹤保護工作,然人數是否足夠?目前追蹤保護工作成效為何?爰要求衛福部督促各縣市主管機關針對居家服務擬定照護精障且失能者之訓練計畫,並檢討現行精神病人社區追蹤保護工作之成效,並於一個月提出改善作為及報告向立法院社會福利及衛生環境委員會報告。
提案人:蔣萬安
連署人:王育敏 陳宜民
七、為防止兒童及少年接觸有害其身心發展之網際網路內容,現行「兒童及少年福利與權益保障法」明定,由國家通訊傳播委員會(NCC)辦理前開有害內容申訴及相關防護機制之建立與執行。惟NCC雖依法委託民間成立iWIN網路內容防護機構受理申訴,然該機構受理申訴後,往往層層函轉,多年來未能落實即時移除網路不當內容,致立法保護兒童及少年之成效不彰。爰建請國家通訊傳播委員會於一個月內,針對上開問題,提出縮短移除網路不當內容處理時效之檢討報告及具體改善方案,確保兒童及少年身心健全發展。
提案人:王育敏
連署人:陳宜民 蔣萬安
八、有鑑於校外人士入侵校園事件頻傳,引發校園安全疑慮,教育部雖已編列相關預算協助校園偏僻地點與危險角落優先設置緊急求救鈴與感應照明燈,惟目前建置進度緩慢,無益於改善校園安全。爰建請教育部提出校園監視器與電子圍籬設置進程,督促加裝設置警監系統(包含電子圍籬)等校園安全相關設備經費立即到位,並於一個月內落實執行。
提案人:王育敏
連署人:陳宜民 蔣萬安
九、有鑑於新興毒品種類日新月異,傳統檢驗儀器已不敷使用,查新興毒品「浴鹽」國內於2012年即已列入二級毒品,然目前警方卻尚未有快篩試劑可供檢驗,難以掌控吸毒者狀況,導致毒品防制成效不佳。爰建請法務部會同內政部警政署及衛生福利部,於一個月內,提出新興毒品防制之改善方案,並針對新興毒品進行資料庫建檔,提供警方相對應之快篩試劑,遏止新興毒品氾濫。
提案人:王育敏
連署人:陳宜民 蔣萬安
十、有鑑於毒品危害防治條例,持有或施用第三級毒品者處新台幣二萬元以上五萬元以下罰鍰,並接受六至八小時毒品危害講習;持有或施用第四級毒品者,處新台幣一萬元至五萬元罰鍰,並接受四至六小時毒品危害講習。然該罰鍰由地方政府收取後,並未專款專用於毒品防治上,致使毒品危害講習淪於形式!爰建議法務部應檢討毒品危害防治條例,針對罰鍰應專款專用於毒品危害防制,包括講習、心理諮詢及後續戒癮,於兩個月內提出檢討報告。
提案人:陳宜民
連署人:蔣萬安 陳 瑩
十一、建請衛福部針對「精神衛生法」修法之問題宜召開公聽會。然「精神衛生法」至今未有徹底執行,在考量人權與醫療專業之際,無從釐清且見仁見智,及資源分配之不均以至落實甚艱。見此,「精神衛生法」之修法應召開公聽會,廣邀各界參與討論一套合乎醫療專業、人權,且實際落實此法之道。
說明:
(一)人權與醫療專業之間涉及人身自由限制,然最終都可聲請由法院審酌合法性。法官保留之部分是否比照國外仍待商議,而精神狀況的判斷則交由醫師建議,但最後法律效果之選擇應回歸法院權責,似較為符合憲法人身自由保障之意旨。再者,如傷人或殺人則是刑法和社會安全體系競合之問題,前者得「暫時剝奪行動自由」,後者則是否「繼續」住院,此宜由法院裁定是否強制,醫師則僅就住院提供必要性建議,並不具有「強制權」。
(二)由此可見,2007年精神衛生法上路,過去只要精障者家屬提出需求,經兩名醫師同意,病患即有強制治療必要,確實有達到社會安定與降低家屬壓力等目的。但人權意識凌駕醫師專業,為顯當事人有表達是否願意住院的權利,時以違反個人自由意志為由,限制醫療專業人員判斷。然以為精障者人權獲得伸張,但鑒於患者重返社區,家屬缺乏專業照護能力,引發社區畏懼,造成社會問題。
(三)目前精神衛生法雖有含納酒癮與毒癮者,但現實執行面相當艱困,因第一線醫護人員在醫療專業與人權往往無法取得平衡下,以致強制將疑似患者就醫治療手段是不可行。於此,勢必放寬酒癮、毒癮者等一併納入強制就醫治療之範圍。
提案人:李彥秀
連署人:王育敏 蔣萬安
散會
主席:請問各位,上次會議議事錄有無錯誤?
請黃委員秀芳發言。
黃委員秀芳:主席、各位同仁。議事錄中臨時提案第2案提到「鑒於根據精神衛生法第三十二條第一項,警察機關及消防機關對於該法第三條第一款所定狀態之人有傷害他人或自己或有傷害之虞者是否護送就醫,各縣市政府警察局、衛生局之認定標準不一。爰建請衛生福利部及內政部召集縣市政府衛生局、警政單位、消防單位檢討及釐清……」,本席希望修正為「……爰建請衛生福利部召集內政部及各縣市政府衛生局、警政單位、消防單位檢討及釐清……」。
主席:請衛福部許次長說明。
許次長銘能:主席、各位委員。昨天本人並沒有在場,但就我以前在地方服務的經驗,有關強制疑似精神病自殺、傷人者送醫的過程,都是由警消單位及衛生單位共同合作,所以若由衛福部召集的話,我想內政部、衛生局的部分是沒有問題,但是召集地方警消單位參與,恐怕是有點困難,加上內政部是負責警消業務的督導,所以我們希望採用昨天的方式,就是由我們和內政部共同召集,可能效率會比較好一些。
黃委員秀芳:我認為要有一個主責單位,所以就是由衛福部擔任主責單位,然後召集其他單位來開會。
許次長銘能:我們是主責單位沒有錯,但那個會議一定是共同召開,而且這又涉及內政部所轄的警消單位,換言之,我們可以一起來召集,但那天的會議一定要跟內政部共同主持,因為這涉及地方權責的分工。
主席:因為昨天現場是有共識的,就是希望內政部在這件事情上還是可以多盡一些力量,而且方才衛福部針對召開會議一事也表示沒有問題。
黃委員秀芳:所以文字上可以這樣修改嗎?即「……爰建請衛生福利部召集內政部及各縣市政府衛生局……」。
主席:方才次長的意思是要與內政部共同主持,即他們可以召開會議,但召開的同時要兩個部會共同主持,如此才可能叫得動下面的單位。
黃委員秀芳:可否召集後共同主持?
主席:那就把內政部跟以下的單位放在同一位置了,所以改為「會同」好嗎?就是「衛生福利部會同內政部」?
黃委員秀芳:好的。
主席:那就修正為「會同」。
請陳委員宜民發言。
陳委員宜民:主席、各位同仁。關於議事錄臨時提案第10案,昨天在質詢法務部時,有要求針對毒品危害防制提出檢討報告,本席希望除了檢討報告外,再加上「含修法建議」等文字。
另外,因為還要談到修法建議,所以時間方面,本席建議將兩個月修正為3個月。謝謝。
主席:陳宜民委員針對昨天的臨時提案第10案做了部分的修正,也跟主管機關達成共識了,所以就依方才陳委員所提內容修正通過,並將其列入議事錄。
請問各位,針對上次會議議事錄有無其他意見?(無)無其他意見,就依方才的修正內容確定。
繼續報告。
二、邀請衛生福利部、中央研究院、行政院科技會報辦公室、經濟部、科技部、財團法人國家衛生研究院、財團法人醫藥品查驗中心、金融監督管理委員會就「我國新藥與疫苗研究開發、上市流程及相關法規之妥適性」列席報告,並備質詢。
主席:今天的議程跟最近熱門的時事有關,就是生技產業在發展的過程中,針對該產業有無按照我們想要的目標發展、是否發生應利益迴避但未迴避等問題來進行探討。的確,生技產業是我們國家重點產業,蔡英文準總統也公開宣示未來五大產業中,生技產業也是很重要的一環,而衛福部主管藥政許可,所以我們認為,應針對這些議題有一些更深入的探討及了解。所以今天的議程是邀請衛生福利部、中央研究院、行政院科技會報辦公室、經濟部、科技部、財團法人國家衛生研究院、財團法人醫藥品查驗中心、金融監督管理委員會就「我國新藥與疫苗研究開發、上市流程及相關法規之妥適性」列席報告,並備質詢。
現在請衛福部許次長報告。
許次長銘能:主席、各位委員。今天 大院第9屆第1會期社會福利及衛生環境委員會召開全體委員會議,本人承邀列席報告,深感榮幸。現在謹就「我國新藥與疫苗研究開發、上市流程及相關法規之妥適性」提出專案報告,敬請各位 委員不吝指教。
壹、新藥與疫苗研究開發上市流程
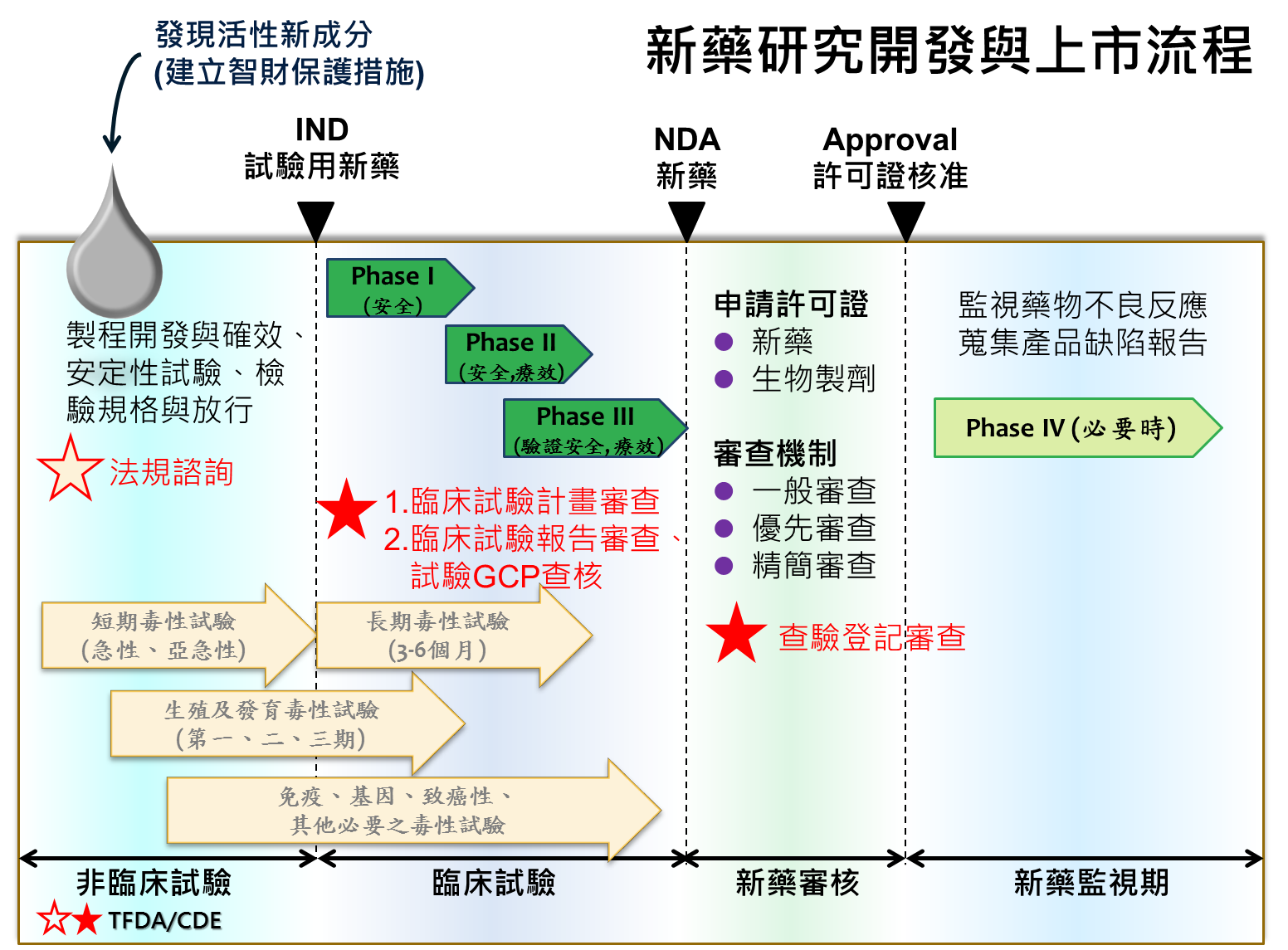
新藥(包含疫苗)從研發到上市是一個漫長、複雜但循序漸進的過程,主要包括以下階段(附圖一):
一、研發探索階段:經由實驗室研究,尋找出具有發展潛力之新藥標的成分。
二、非臨床試驗階段:進行藥品製程開發、進行動物藥理、毒性及安全性試驗,研究該活性成分安全性與可能的療效。
三、臨床試驗階段:研擬臨床試驗計畫向中央主管機關提出申請,經審核通過後方可執行,透過充分且嚴謹的第一期至第三期臨床試驗,驗證該活性成分於人體的安全性及療效。
四、查驗登記申請:備齊該活性成分之製程管控、非臨床試驗及臨床試驗資料,向中央主管機關申請新藥上市,經審核通過核發藥品許可證後方可製造販賣。
五、新藥安全監視階段:上市後,在大規模病人使用下監視藥品嚴重不良反應之發生情形。
貳、國內藥品管理規範
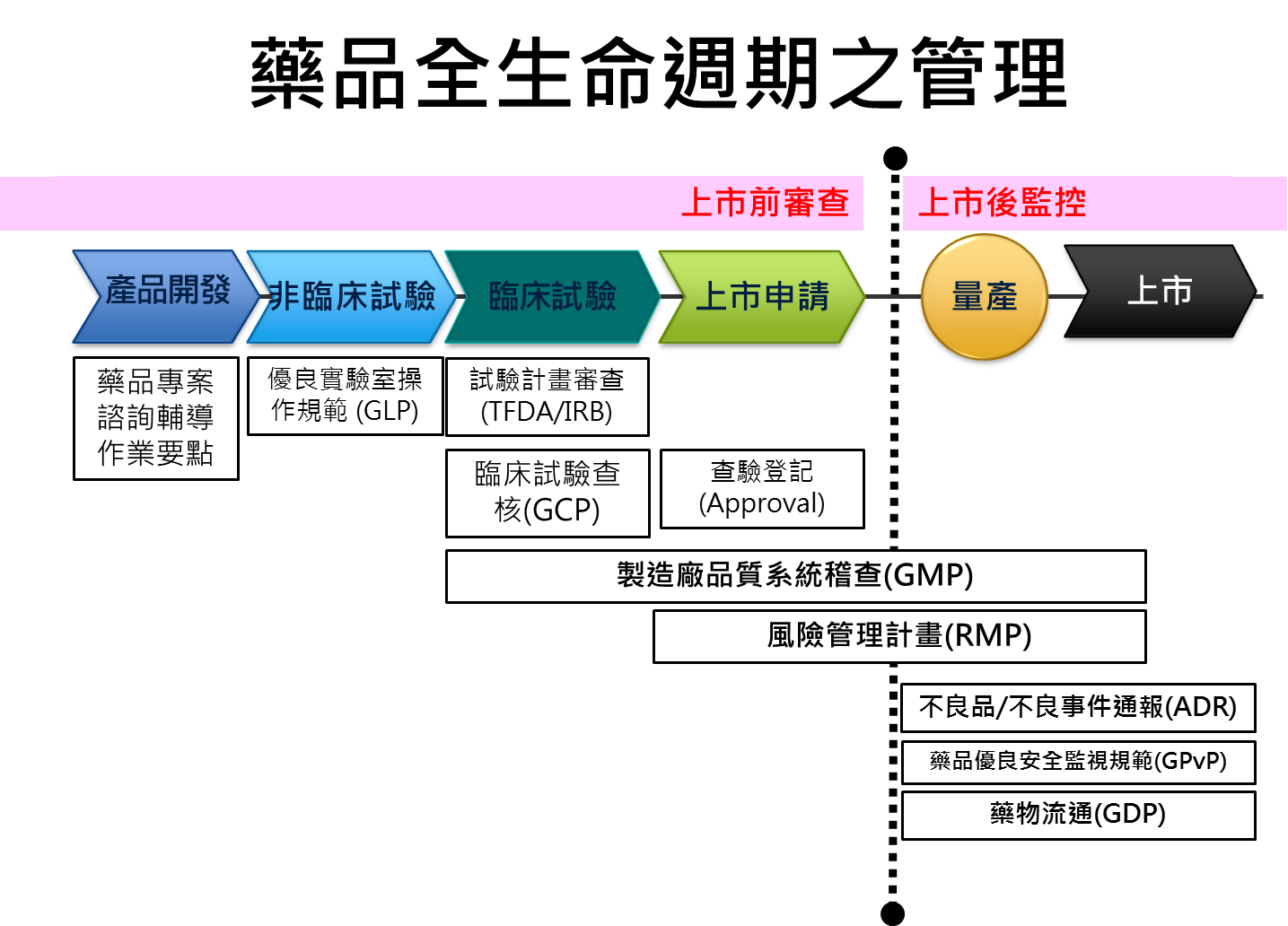
一、藥品全生命週期管理
為保障民眾用藥之安全,並兼顧創新藥品研發,增加民眾用藥可近性,本部已建置完整的藥政管理體系,包括提供法規科學諮詢輔導、藥政管理法規擬訂、臨床試驗與查驗登記審核、及藥品製造廠查核與產品檢驗等監督管理。以上市前查驗登記、藥品樣品檢驗以及各項藥品優良規範(GXP),包含上市前非臨床試驗優良操作規範(GLP)、優良臨床試驗規範(GCP)、優良製造規範(PIC/S GMP),及上市後藥品優良安全監視規範(GPvP)、優良運銷規範(GDP)等要求,達成藥品全生命週期的管理(附圖二)。
二、藥品審查標準符合國際規範
在查驗登記審查部分,我國藥品法規科學審查要項,與國際是一致的,係參照國際醫藥法規協合會(International Conference on Harmonization, ICH)國際公認之規範進行審查,審查內容包括「化學製造管制審查」確保原料藥/製劑的製造品質,「藥動藥效學審查」了解藥品的吸收、分布、代謝、排泄等特性,「藥毒理審查」著重在動物試驗的藥效及安全性資訊,「臨床統計審查」則是針對臨床試驗資料整體評估藥品的療效及安全性,以藥品安全(Safety)、有效(Efficacy)及品質(Quality)為三大訴求。
三、持續精進藥政審查法規與審查效能
因應全球化市場發展及國際法規協和化趨勢,藥政管理法規須與時俱進,本部持續檢視修訂藥物相關管理規範以符合國內需求,並參酌先進國家規定以與國際接軌。104年共修訂22項藥品相關法規或基準,並且持續精進審查,提高效能及透明度,104年計核准新藥申請案170件、臨床試驗計畫案230件,專案諮詢輔導國內開發新藥2件核准上市。
此外,我國西藥藥品的製造已於103年12月31日全面完成實施國際最嚴謹的PIC/S GMP標準,並持續將優良運銷規範納入藥品的貯存與運送,從源頭管制、穩定製造、安全運銷的全方位管理,確保所有上市的藥品在有效期限內維持其應有的品質。
參、藥品審查程序
藥商依據藥事法第39條及藥品查驗登記審查準則規定備齊行政文件、藥品製造品質、非臨床動物試驗及人體臨床試驗等技術性文件,向本部食品藥物管理署(以下簡稱食藥署)提出申請,食藥署受理後將技術性文件資料委託財團法人醫藥品查驗中心進行審查,該中心依據我國公告相關法規基準及ICH國際相關規範進行技術文件及數據審查,審查完成後提供審查報告予食藥署,作為查驗登記准駁及核發許可證之參據。
肆、結語
我國藥品查驗登記管理制度多年來與時俱進與國際接軌,目前已建置嚴謹的藥品查驗登記審核管理,同時亦建置法規科學諮詢輔導機制,本部將持續精進各項審查管理機制,促進新藥研發上市。本部承 大院各委員對業務推動之支持與協助,在此敬致謝忱。尚祈 各位委員,繼續給予支持。
附圖一
附圖二
主席:附圖一、二很重要,請補充說明。
許次長銘能:附圖一、二是關於新藥研究開發與上市流程,包括非臨床試驗、臨床試驗、新藥審核、新藥監視期等4個時期,在臨床前這一塊是關於毒理、藥理等非臨床部分的審查,而其安全性、有效性在動物實驗及相關毒理實驗得到一個標準之後,才依照相關的資料來跟食藥署申請臨床試驗的執行,所以執行之前還是需要非常嚴謹地依據非臨床試驗的相關數據及資料進行臨床試驗的分期。一期、二期及三期會各自依照各期不同的結果進行下一期,申請的時候都需要更嚴謹地審核相關的數據,以核准其進入下一期相關臨床試驗的進行。
臨床試驗結束之後,會就臨床試驗中完成的相關資料,再就其資料的內容,進行相關資料的核對。這裡有所謂的GCP查核,就是到各個臨床試驗的醫院就其所蒐集的相關資料是否正確、是否符合相關臨床試驗的規範等蒐集病患的數據,以確定這些數據的有效性。也就是透過GCP查核更進一步查核相關資料的正確性,之後再依照資料的正確性判定其是否符合有效、安全的證據,進行後續的新藥審核過程。
新藥審核的過程中會就其所提供臨床試驗的數據,以及所有毒理、藥理等等相關的資訊做最後的終審。在終審的過程中,必要的時候也會提請各方面的學者專家或臨床的醫師就其所提出的相關數據及證據,決定是否核准上市。
最後,依照相關的資料審核的結果,若是可以許可上市,就會發放許可證。許可證發放之後,對於大量使用在臨床病人身上的藥品,也會要求業者或藥商持續於上市後在臨床上蒐集副作用或療效等等有關安全的進一步資料,供作5年之後再次更換藥品許可證時的評估;如果發生很嚴重後遺症的時候,也可以根據相關的資訊撤除許可證,以避免藥品對人體產生危害。
所以整個程序是經過一道、一道關卡的審核及科學證據的認定,來進行藥品的相關許可上市及上市後相關的監視查核。
主席:謝謝衛福部許次長針對藥品如何審核、上市、開發流程等等所做的報告。
現在開始進行詢答,每位委員質詢8分鐘,得延長2分鐘;上午10時30分截止發言登記;委員如有書面質詢,請於散會前提出,逾期不受理;中午12時開始處理臨時提案。
請林委員靜儀質詢。
林委員靜儀:主席、各位列席官員、各位同仁。請問次長,您知道昨天蘋果日報的頭版在報導一個新藥嗎?還是您沒有看報紙?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。還沒詳細地看到。
林委員靜儀:好。如果衛福部對這個藥品這麼沒有感覺的話,我真的要提醒你們,你們到時候會被藥廠押著跑。
投影片上是上個禮拜的新聞,我發現這個藥品其實已經在上個禮拜就公布,現在民眾很關切這個非常昂貴的C肝新藥,據說它原先研發出來的時候1顆要價1,000美金,現在是100美金。昨天的新聞做得很大,報導了一大堆,指稱民眾非常期待這個新藥,廠商一直告訴民眾健保署、衛福部會協助。昨天廠商表示將釋出50個名額送給民眾使用,我想請問次長,我們對於藥物的樣品或贈品的管理有沒有相關的法規?
許次長銘能:有,藥事法對於藥品的贈品及樣品都有相關的規範。
林委員靜儀:所以雖然這個藥品是臺灣已經核准的藥,可是還沒有根據我們的法規讓它上市使用,這50名個案的贈藥算是藥物的樣品或藥物的贈品?
許次長銘能:就食藥署相關的資料,這個藥品實際上已經拿到許可證了……
林委員靜儀:對,拿到許可證了,我知道。
許次長銘能:可以正式上市販售。
林委員靜儀:對,可是販售了嗎?
許次長銘能:在還沒有正式販售的情況下,它可以用販售的方式做藥品的販賣,但是藥商基於什麼樣的理由願意贈藥?事實上它並不屬於未核准上市之前的階段,為了病患的使用,可以用贈藥的方式,但是還要向我們申請,這是指未上市的部分。
林委員靜儀:這個是已上市,我知道,但是它是藥物樣品還是藥物贈品?
許次長銘能:理論上,它不能叫做樣品或贈品,它就是合法上市的藥品。
林委員靜儀:你剛剛說在贈送藥品的部分,我們有法規規範?
許次長銘能:詳細的法規內容,是不是可以請王組長向委員做簡單的說明好嗎?
林委員靜儀:好。請告訴我,它是一個藥品,廠商要送的藥是樣品還是贈品?
主席:請衛福部食藥署藥品組王組長答復。
王組長兆儀:主席、各位委員。依據藥物樣品贈品管理辦法,如果要贈送的話,必須先向我們申請。
林委員靜儀:昨天廠商大張旗鼓地用新聞稿宣稱要贈送50個個案,請問一下,你們拿到申請書了嗎?
王組長兆儀:目前我們還沒有收到申請。
林委員靜儀:這個藥商昨天已經說了,他們的辦法都出來了。你的意思是,它也不符合樣品的規範?
王組長兆儀:它是合法的藥品,但是必須先向我們申請贈品,才會變成贈品。
林委員靜儀:根據前述辦法第四條第一項的規定,如果是贈品,必須要敘明理由,並檢附申請者資格證明文件,向中央衛生主管機關提出申請,經核准後始可提取。根據昨天的新聞,他們在網站上已經開放了,直接說有開放這個方法,請各位民眾自己拿著資料向他們申請,請問這個部分有沒有違法?
許次長銘能:我認為這部分就程序上而言,仍然必須經由藥事法相關程序完成後才可以贈送。
林委員靜儀:可是他們昨天已經向民眾宣布,歡迎民眾提具所有資料向他們申請。
許次長銘能:當然,這部分我們會進一步了解其申請的程序是否完備。
林委員靜儀:至今你們都不管嗎?如果在民眾申請完畢後,你們才宣布這樣不行,難道你們要承擔民眾的抱怨嗎?
許次長銘能:對這部分我們一定會再做了解,因為它的申請須有相關程序。
林委員靜儀:截至目前為止,你們尚未接到這家新藥廠商向你們提出贈藥的申請?
許次長銘能:沒有。
林委員靜儀:醫院若要提出贈藥申請,醫院內部都有類此的管控,必須向中央主管機關提出,也就是說廠商完全沒有進行這樣的流程,對吧?
許次長銘能:對。
林委員靜儀:昨天廠商召開記者會表示,請大家向他們申請,若申請後他們會審查資格是否符合,同時將在5月25日召開記者會公開抽籤,抽出50名幸運得主,可以獲贈此一昂貴藥品,請問衛福部如何控管此事?
許次長銘能:既然廠商未完成相關程序,我們會依據藥事法相關規定,予以限期改正通知。
林委員靜儀:對此除了限期改正之外,是否進行裁罰?
許次長銘能:有,這部分訂有3至15萬罰鍰。
林委員靜儀:廠商如此手法的廣告效益很高,竟只有3至15萬罰鍰,不如他登……
許次長銘能:廠商透過新聞的方式,涉嫌促銷廣告相關藥品的部分,我們將會依據藥事法以及相關廣告的規定來予以裁罰。
林委員靜儀:你是指此事牽涉藥品促銷廣告的部分,是嗎?
許次長銘能:有此嫌疑,但必須進一步處理。
林委員靜儀:廠商的網站公開載明一些方法,包括被抽中的50名幸運得主必須配合抽血,請問這部分是否屬於人體試驗?
許次長銘能:一般藥品在上市前,臨床部分的試驗已經完成,至於業者要抽血做進一步相關評估,是由業者與民眾取得……
林委員靜儀:您剛才說申請的部分,應該是指比方說由提供贈藥的專科醫師或者是醫院、單位,向你們提出申請並核可後才能處理。請你不要幫他們解套這件事,我現在要問的是,究竟其中是否涉及人體試驗與倫理道德的問題?
許次長銘能:我認為這部分尚待進一步了解其贈藥的過程。
林委員靜儀:有關贈藥的過程我都有提供給你,他們就是以捐贈的方式進行。
許次長銘能:若是他們有抽血與執行後續追蹤的部分,一定必須在申請文件中明述類此資料,以供我們進行相關審核。
林委員靜儀:所以,你們的審核過程有包括人體試驗?
許次長銘能:這並非人體試驗。
林委員靜儀:廠商以抽籤的方式來進行,假設現有1,000名病友申請參加,只有50名抽中,在此過程中其餘的950名病友將成為未被治療的個案,這部分是否涉有道德倫理的問題?因為廠商誘使病人,並表明後續可免費提供一項很貴的藥品給病人,在這個過程中許多病人因此未受治療且延誤病情,請問廠商是否涉有道德及刑罰的問題?
許次長銘能:廠商提供贈藥的部分必須經過審核的程序,同時在過程中僅限制某些對象是否涉及道德風險一事,我們將透過審核的程序,以考量是否涉及道德風險的問題。
林委員靜儀:請問過去國內曾有廠商以抽獎的方式贈藥嗎?
許次長銘能:目前未曾有類此案例。
林委員靜儀:衛福部有可能接受任何藥品試驗或贈品以抽籤的方式進行嗎?
許次長銘能:針對這部分我們會以相關法令加以審核,至於抽籤程序部分是否有相關倫理的考量與瑕疵,我們會一併請相關倫理學者對此進行研議。
林委員靜儀:次長,我感到非常困擾,我並非拒絕這項藥品進入市場供民眾使用,可是你們失職,在此過程中任由廠商大打廣告給予民眾不適當的期待,讓民眾誤以為是本席反對這項藥品!你們在此過程中,對於違反醫療倫理、違反治療倫理以及藥事法等情事,竟然一聲不吭!還要本席在此質詢你們,讓民眾以為是我阻擋這項藥品!今天你們是否能就以抽籤方式贈藥一事,其未經過事先申請,違反藥事法第五十五條第二項規定的部分,立即做出說明並進行該有的禁止動作,將職責拉回衛福部,請問你們可以做到嗎?
許次長銘能:可以,對此我們會立即進行調查。
林委員靜儀:此外,這項藥品價格昂貴,請你們查明廠商是否該負擔贈與稅?
最後再請教次長,請健保署及衛福部告訴我們,假設國內要納入各種比較新或是好的治療,你們是以何種機制處理以及如何劃分健保預算?容我提醒你們一件事,去年為了選舉,為讓大老闆們高興,你們調降了健保費,讓健保收入每年減少高達兩百一十億,然在如今各種新藥及好藥的需求紛紛出現,請問健保署是否有任何的機制告訴我們,當新藥進入國內時,你們如何告知民眾,因健保經費不足,導致某些藥品必須自費負擔?
許次長銘能:容我請健保署李副署長回答。
主席:請衛福部健保署李副署長答復。
李副署長丞華:主席、各位委員。這部分主要是牽涉藥品的預算衝擊,若在一定範圍內,我們是按照健保法第四十一條審查,由共同擬定會議決定,如果預算超過相當大的數字的話,將依照健保法第五條提到健保會審議。
林委員靜儀:健保會在審議時,他們能夠知道這部分納入對於其他藥品會產生排擠效應嗎?
李副署長丞華:例如我們擴大很多藥品項目的時候,將牽涉下年度的預算,此部分費率的審查,或者是保費是否須調整等事項,就會被納入他們年度性的考量當中。
林委員靜儀:因此,對於某些藥品不再提供健保給付,或是你們壓縮醫療人員的裁量或額度,你們會告訴民眾嗎?
李副署長丞華:這部分按照相關法規屬於全民健保會職掌,由各方的利益關係人共同審議,所以,事實上全民健保會凌駕於健保局之上,包括費率的審查及總額預算都屬此會職權。
林委員靜儀:本席在此作一個結論:健保署不能將大餅越做越小,還向民眾保證全都吃到飽!
李副署長丞華:是。
林委員靜儀:請衛福部今天就將此廠商違反藥事法贈藥作法的事件立即處理!
許次長銘能:是,謝謝委員。
主席:請吳委員焜裕質詢。
吳委員焜裕:主席、各位列席官員、各位同仁。首先,本席在此感謝參加新藥開發的各單位,包括科技部、經濟部、衛福部以及原能會,據了解,你們一年預算總共約20億元,但你們提交予委員的報告,真的很體諒委員,怕委員沒時間看,所以各單位都只繳交幾頁的報告書,我真的非常感謝你們體諒委員的辛勞,怕我們必須晚上熬夜看報告,所以送來的報告都僅有幾頁,但是平均每年以20億元預算來進行新藥開發相關研究。希望在座各位媒體先生及小姐們稍做注意,他們每年獲得20億元預算,但提交予立法委員的報告,每份僅有30頁而已,這些報告每一頁真的都非常貴!
其實,從2012年H1N1疫苗造成爭論後,本席就開始對此進行評估,今天感謝召委排定此一議題,讓我們一同探討疫苗的安全性。首先,本席先澄清一事,我贊同施打疫苗,但在施打之前,我們應該確保疫苗的安全性。請問次長,國內的疫苗是由哪個單位負責評估?應該由誰執行?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。疫苗的安全性是由本部食品藥物管理署依相關法規管理。
吳委員焜裕:請問署長,誰在執行疫苗安全性的工作?
主席:請衛福部食藥署姜署長答復。
姜署長郁美:主席、各位委員。疫苗及新藥開發過程中的相關工作,都由食藥署及醫藥品查驗中心共同執行。
吳委員焜裕:請問疫苗的保存劑也就是硫柳汞(Thimerosal)的安全性如何評估?
姜署長郁美:這部分請藥品組的王組長說明。
主席:請衛福部食藥署藥品組王組長答復。
王組長兆儀:主席、各位委員。所謂的硫柳汞是一種保存劑,主要是怕疫苗在運送期間受到感染,技術上,我們的CDE會參考國際規範去做評估。
吳委員焜裕:國際上是如何評估的?
王組長兆儀:國外訂有安全標準,臺灣也都符合其標準。
吳委員焜裕:你們知道硫柳汞的毒理嗎?會在體內代謝成什麼東西?
主席:請衛福部醫藥品查驗中心高執行長答復。
高執行長純琇:主席、各位委員。硫柳汞是有機汞……
吳委員焜裕:有機汞的種類很多,這是哪種有機汞?不知道?你們實在相當不專業!這是國際上非常重視、尤其是在疫苗的安全性上非常重要的問題,結果你們卻搞不清楚,乾脆由本席來告訴大家好了。硫柳汞在體內會代謝成甲基汞、乙基汞,本來只認為會代謝成乙基汞,但在動物實驗中,確實在組織中量到會代謝成甲基汞,大家知道甲基汞有多毒嗎?1997年,美國一位非常有名的神經毒理學家雖然戴了防護手套做實驗,只因不小心滴了一滴在手套上,一個月後就死亡了,國際上非常清楚甲基汞的毒性,而我們居然不知道對硫柳汞做風險及安全性評估,這不禁讓我們質疑國內疫苗的安全性,因為我們很多疫苗都含有硫柳汞,比如B型肝炎、破傷風、百日咳等疫苗,臺大的黃醫師就已經說過,這不是新聞,只要是不活化的死疫苗都會含有硫柳汞,但是負責此事的主管單位卻完全不清楚要如何對硫柳汞做安全評估。
高執行長純琇:我本身不是藥毒理專家,但我們查驗中心有專門審驗藥毒理的人員,……
吳委員焜裕:問題是你們如何進行評估?
高執行長純琇:會從疫苗先前進行的動物實驗以及國際上對硫柳汞有安全限量標準……
吳委員焜裕:你可能不清楚國際上的作法,本席從2010年H1N1發生爭論時就開始進行評估,當年年底,國家衛生研究院舉辦的實證醫學研討會邀請我去發表這方面的論文,當時對此論文的評論人是國衛院疫苗中心主任,他不敢說我的論文有問題,而是說礙於預算,所以購買含有硫柳汞的疫苗,可見連疫苗中心的主任都承認我做的是對的。
高執行長純琇:當初應該是兩種都有。
吳委員焜裕:出問題的可能都是打到含有硫柳汞疫苗的人,我們針對剛出生的嬰兒到一歲幼兒被施打含硫柳汞疫苗的情形做了風險評估,包括考慮甲基汞毒性、安全劑量等,以觀察期40天來說,只要指數大於1都是有風險的,一直要到200天也就是將近一歲時,風險才可能比較低。我還特別去參加了當年歐洲毒理學會的疫苗安全性工作坊(workshop),分別請問美國、德國和日本的代表他們是如何評估的,他們共同的答案是這是他們自己國內非常具有爭議性的議題,所以不敢對小孩使用含有硫柳汞的疫苗,但是我們國內卻完全沒有注意到此事。現在美國的愛荷華州、加州及英國都禁用含有硫柳汞的疫苗,請問我們呢?當年幫本席做這個評估的是市立聯合醫院忠孝醫院的一位醫師,他告訴我美國對3歲以下幼兒禁打含硫柳汞疫苗,可是國內竟然忽略此事,導致H1N1流行當年有10個孩子死亡,而我們卻很快就聲稱此與疫苗無關,請問我們到底是如何評估的?這和食品安全、環境議題一樣,事後來看很難建構因果關係,只能採行預防措施,保護我們的孩童,所以本席建議未來施打疫苗時要注意施打對象,考慮孕婦與幼童是否能夠施打此種疫苗及其安全性,比如HPV,現在日本已經有人要對疫苗公司提出訴訟,這方面的副作用也是應該注意的。講到新藥開發,就要提到到底應由誰宣布臨床實驗的解盲才會比較客觀的問題,比如最近有家生技公司(不是浩鼎)宣布解盲結果是達標,卻不敢說臨床實驗是否成功,可是股票卻因此上漲,其實成不成功一看就知,但是這樣的宣布,對社會、對股票市場和股票投資人是否公平?我想食藥署應該考慮未來解盲時由具客觀立場的人去詮釋,這明明只是yes or no的事,為何會有模糊空間讓這些業者操作?
另外,本席在總質詢時問到科技部到底在食品安全研究方面花了多少經費,請問次長,對違反學術倫理、藐視立法院者應如何裁罰?
主席:請科技部錢次長答復。
錢次長宗良:主席、各位委員。請委員說明此一問題的重點是……
吳委員焜裕:本席要問的是若有違反學術倫理情事,科技部會如何處理。
錢次長宗良:我們有一個相關的獨立委員會會去查察。
吳委員焜裕:如果情節確定,要如何懲罰?
錢次長宗良:停權。
吳委員焜裕:停什麼權?
錢次長宗良:申請……
吳委員焜裕:國科會的計畫?
錢次長宗良:是。
吳委員焜裕:那藐視立委要怎麼做?請看下一張。我問說花多少經費進行食品安全的評估,竟然回答說你們有創新的食品營養保健學門,而且投入多少錢云云。根本不要騙人了!這只是因為裘正健擔任生科司司長時,把舊有的很多學門整合成一個學門,它不是新創的,而且這個學門做的跟食品安全完全無關!如果連科技部部長、生科司司長都搞不懂食品營養保健在做什麼研究,那還做什麼部長、司長?以為在SCI國際期刊發表一份高點數的文章就可以當司長嗎?完全藐視立法院的質詢,欺騙立委!本席認為應該針對部長及生科司司長違反學術倫理做出懲罰,我會想辦法提案。謝謝。
主席:請劉委員建國質詢。
劉委員建國:主席、各位列席官員、各位同仁。昨天我和陳宜民委員應邀到遠見雜誌參加一個論壇,主要是針對新藥的部分做一些討論,因此,我很詳細的再拜讀一遍遠見雜誌的相關內容,現在我就從中逐一就教次長。
首先,我認為今天主席安排這個議程滿不錯的,所以我想請問,浩鼎解盲失敗這件事會不會導致臺灣生技產業變成「浩劫到頂」?會不會由這個事件,讓我們看到國家政府面對國內廠家在製造新藥的整個過程裡面,到底扮演什麼角色?尤其是衛福部FDA及CDE等等,在這些藥廠製造新藥的過程中,到底發揮什麼功能?次長,浩鼎當時標榜在臺灣進行新藥第二、三期臨床試驗,相對於其他國家是先做第二期,再做第三期,為什麼浩鼎可以一次就做二、三期?在這個過程中,我們看不到他們當初的protocol,所以不了解他們為什麼要選擇這樣的臨床試驗?請教次長,他們設計送審有透過CDE或FDA做充分溝通嗎?政府在這個階段,相關主管機關到底扮演什麼角色?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。感謝委員指教,有關新藥上市之前臨床試驗這部分,我們是依照相關法規嚴加審核它的臨床試驗可否用在人體上,以避免受試者受到傷害。除此之外,我們也在業者進行臨床試驗時,提供相關的法令規定及訊息,請他們依照處理。
劉委員建國:次長的意思是,不管FDA或CDE都有給他們充分的建議和訊息?
許次長銘能:是。
劉委員建國:確定嗎?
許次長銘能:是。
劉委員建國:如果這樣,為什麼國外是一期一期做,浩鼎卻是兩期一併做?
許次長銘能:我想這是因為業者自己在臨床試驗計畫上的考量使然,這個考量在當時一定經過充分討論;詳細部分,我請CDE詹組長就當時諮詢情形及提供資訊方面向委員簡要說明。
主席:請衛福部醫藥品查驗中心新藥科技組詹組長答復。
詹組長明曉:主席、各位委員。當初浩鼎進行二、三期試驗的這種彈性作法,在目前世界各國新藥研發的過程中,算是一種滿常見的作法,所以這種作法並不奇怪,只要講清楚二、三期的分界及標準,好比什麼情況下可以進入第三期,那就符合國際規範。
劉委員建國:所以它有符合國際規範,也就是說,它照這樣的程序來走,是沒有問題的,可是最終它還是解盲失敗。我要講的是,一般新藥從申請到上市,那段時間是非常冗長的,所以我才會期待CDE及FDA發揮更強、更好的功能,否則國內生技產業勢必因為這個事件受到影響,同時也會讓爾後我們的期待值出現極大落差。這是本席擔憂的地方。
另外,諾西代是屬於特殊族群的用藥,所以在很危急且沒有其他替代藥物的情況下,政府應該介入協助並積極輔導,而不是以管制的態度去做處理,這樣才能縮短新藥上市的時間。可以嗎?
許次長銘能:我想有關新藥上市的諮詢部分,在CDE或FDA已經做了非常長的一段時間,其實我們也不止是針對浩鼎這家公司所研發的新藥進行適當輔導,對於一些具特別指標性的新藥開發之國內業者,我們是在臨床前期就已開始介入,並且提供相關正確的資訊,讓業者蒐集資料時能夠更加精準明確。這個工作,我們一直持續在做。
劉委員建國:畢竟這個東西如果可以順利上市,基本上造福的也是國人。我從遠見雜誌裡面還看到,倘若浩鼎往後在臨床試驗過程裡面有設計修正,最終還是可以申請到藥證,就如同生產新藥「太捷信膠囊250毫克」的太景以及寶齡富錦生技等,這些都是本土的藥廠和生技公司。據我了解,國際的藥廠背後都有一個國際總部給予經濟上的支援,相形之下,臺灣在藥品計畫上市的同時,也有相關的輔導和經濟上的支援嗎?
許次長銘能:我們的輔導對象,針對的不是只有藥廠,其實科技部有一個NRPB計畫,就是針對臨床醫師主動提出的新藥開發計畫,成立特別專案來提供相關的諮商和輔導。
劉委員建國:不是東一塊、西一塊的教育委辦計畫?
許次長銘能:不是,包括科技部、經濟部,都會提供固定、長期的諮詢。
劉委員建國:我剛才說了,人家國外都有一個國際總部提供經濟支援,那臺灣政府有嗎?
許次長銘能:有關這部分,經濟部有科專計畫,而科技部也有NRPB國家生技發展相關計畫,一直都在鼓勵新藥研發的基礎工作,甚至我們國衛院也編列了一些科研計畫經費來support新藥開發。另外,我們也接受科技部相關經費的挹注,委託CDE針對國內新藥研發的案子提供諮商及輔導。
劉委員建國:OK。目前臺灣新藥占全球市場比例是多少?
許次長銘能:不到5%。
劉委員建國:應該是不到0.4%吧?比例非常小。事實上,就算臺灣藥廠願意投入大筆的研發經費,讓新藥可以順利上市,但它在臺灣上市,並不代表它可以到國外去競爭,所以在此情形下,我們如何扶植這些產業,恐怕有賴政府發揮更強的功能,這樣的話,對於生技產業,我們才能有所期待。對不對?
許次長銘能:其實這十幾年來,對於新藥的研發和開發,經濟部、科技部及衛福部等相關單位,已經統合所有力量提供集中的支援,讓新藥在發展過程中,能夠更有利基取得上市許可;同時因為我們是用國際法規來審查,所以經由臺灣上市的這些藥品,已具備國際競爭力,可以到世界其他國家去申請許可證。
劉委員建國:我們是用國際法規來審查?
許次長銘能:對,我們是比照國際相關的一些……
劉委員建國:可是我覺得我們好像沒有國外那麼嚴謹耶!這篇報導裡面也寫了,目前國內針對新藥上市的法規確實沒有國外嚴謹,所以要更加精進才能符合歐美標準。也就是說,國內藥廠要往國外賣藥,通常必須和國外廠商合作才有辦法。請問你們對於這件事的看法如何?
許次長銘能:我想藥品法規的確要與時俱進,所以我們也參加國際有關藥品審查的組織,在這個組織裡面,我們占有非常重要的領導地位,同時也提供相關的一些協助,可見在這個領域上,我們跟世界是走在一起的。至於國內藥品要賣到國外,是否要找國外廠商合作?這涉及申請藥證及後續上市的布局,所以是否需要一些合作夥伴,這要由廠商基於商業考量來做取捨。
劉委員建國:針對新藥的查驗登記或上市後管理,我想很多法規都需要額外公告來做一些解釋或加強,這個應該是有必要吧?
許次長銘能:是。
劉委員建國:我是由這次事件才整體了解到在臺灣製造新藥的過程裡,有些法規內容和狀態都必須要再做調整,所以我剛才開場白就指出,不要讓臺灣的生技產業真的像浩鼎一樣變成「浩劫到頂」!有位從貴部退休的官員告訴我,臺灣生技產業很有未來性,未來創造的產值可能1年高達1兆以上。這當然是不及食品加工,但它未來的潛力真的非常大;不過,政府在相關政策配套上,應該扮演更積極、更有power的角色,這樣才能讓新藥上市在造福國人之餘,還可以到國外去競爭,不要永遠都占國外市場不到5%,否則就太漏氣了!
許次長銘能:我想在跨部會連結的這一塊,如何讓臺灣的生技產業能夠進入國際市場,這是政府非常重要的事情,未來我們會在既有的基礎上進一步投入,俾讓臺灣的生技產業更加發展。
劉委員建國:好,謝謝。
主席(陳委員宜民代):請王委員育敏質詢。
王委員育敏:主席、各位列席官員、各位同仁。今天安排這個議程,主要就是邀請相關部門以你們的專業來幫我們解盲,因為這陣子大家看到新藥是否取得核准藥證以及可不可以上市等等的問題,其實媒體對此討論非常多,但是我們立法院並未安排專業的相關部門來幫大家解盲,所以今天我有幾個問題要請教次長。
首先,2月21日中研院翁院長提及:「疫苗跟藥物不一樣,不應以藥物的標準來看待疫苗,這要好好跟衛福部談。」,我不知道你們有沒有聽過這段話?我也不知道翁院長後來有沒有跟你們談?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。沒有。
王委員育敏:我的疑問是,為什麼疫苗跟藥物的審查標準不同?按照你們現在整個審核歷程來看,這兩者是否真的走不一樣的流程?
許次長銘能:有關藥物的部分,對於新藥的開發,我們審查的基本邏輯其實是一樣的,經由的程序、走的路都是一致的方式;至於疫苗的部分,還有更多的規定,現在要求疫苗一定要符合它特有的規定。
王委員育敏:翁院長說疫苗跟藥物不一樣,不應以藥物的標準看待,而次長則說疫苗的標準可能比藥物還嚴格,是嗎?
許次長銘能:這點我請詹組長向委員做專業的說明。
主席:請衛福部醫藥品查驗中心新藥科技組詹組長答復。
詹組長明曉:主席、各位委員。首先向委員說明,翁院長沒有問我。如果從這個字面上的解讀,我不以法論法,他講的應該是疫苗和平常化學性藥物的作用機制不一樣,因為疫苗是個生物製劑,它的作用機轉是透過免疫的反應,所以它在臨床上的表現會和我們平常服用一顆顆的藥丸或施打化學藥物的表現不同。也就是說,翁院長的意思是,這樣的新興製劑,在你看待療效及安全性時,要有不一樣的眼光。那這個也必須要有數據資料送過來才知道,可是從頭到尾,我們都還沒有收到任何資料。但不論如何,我可以了解翁院長的意思,應該是從科學面來講這個層次,亦即面對新興藥品的發展,他的解讀應該是這樣。謝謝。
王委員育敏:好。你們在報告中提到,目前國內對於新藥的審查是根據ICH的標準,也就是說,如果一個新藥因解盲失敗,無法在國內申請成功,那麼它以同樣的模式到其他國家申請會成功嗎?
許次長銘能:如果這個國家也是follow ICH的標準,那麼幾乎都是以一致的標準在做審查。
王委員育敏:所以如果follow ICH的標準,大家的審查標準是一致的?
許次長銘能:當然,臨床試驗有它臨床試驗的結果,這個結果會成為它後面可否上市的重要依據。目前所有的臨床試驗都是依照ICH的法規規定來執行,只是結果是否如預期就不一定,因為我們對於效果和安全會嚴加把關。
王委員育敏:對,你在報告中也提到,針對新藥的審查,重視的就是安全和效果。
另外,本席請教,解盲成功或失敗,到目前為止,在國內是由哪個單位認定?抑或是由試驗團隊自行宣告?
許次長銘能:其實解盲最後的結果,還必須將所有資料送到食藥署,然後食藥署再找CDE就資料內容逐一審視,而在審視之前還有一段工作,就是這些資料是從各醫院所蒐集而來,所以我們要去查核各醫院提送資料的正確性,之後才會就資料進行分析和探討,它是有層次的處理。
王委員育敏:最終是由衛福部判定?
許次長銘能:對。
王委員育敏:這次浩鼎事件,是由誰來判定?你們判定了嗎?結果有送到你們這邊來嗎?
許次長銘能:還沒。
王委員育敏:還是研究團隊就自行宣告解盲失敗?
許次長銘能:對。解盲是他們在試驗過程中會做的一個程序,但是結果如何以及是否對外宣布,是由他們整個專業團隊來做處理;至於解盲之後把結果送到衛福部來,還是要有個程序處理,我們到現在為止,還沒啟動這個程序。
王委員育敏:浩鼎自行宣布解盲失敗,但又說只是沒有達到標準,請問在此情形下,它這個個案還需不需要送到衛福部?他們有沒有送?
許次長銘能:還沒送。
王委員育敏:你們還沒收到他們相關的data?
許次長銘能:是。
王委員育敏:你剛才說最終要由衛福部來判定,那如果有一家生技公司宣稱解盲失敗,但又說它只是沒有達到標準。請問一般人聽到這樣的資訊,要如何解讀?如果是投資人要投資這家公司的股票,聽到這樣的訊息,到底是該繼續投資?還是要趕快撤出?這種訊息感覺上像是相互矛盾的雙重訊息,因為既說解盲失敗,又說只是沒有達到標準,意思就是後面還有「……」。做為主管機關,你們怎麼看待這種資訊?難道這種資訊的解讀不應該比較一致嗎?
許次長銘能:當時針對這部分,我們是要等到它整理好後面的相關資料,再依照審查程序送到食藥署來以後,才會就內容部分進行實質審查;至於它說有沒有達到標準,只是它自己的價值判斷。其實我們對外也說明了,這件事還是要回歸法規來做相關的審查……
王委員育敏:對,本席認為這種結果判讀滿專業的,它會影響到後面股價的表現及投資人的信心,所以本席希望未來能夠建立一個比較科學且一致的標準,譬如就由衛福部來宣告解盲結果是成功或失敗,也就是最終民眾要解讀的資訊是由官方統一公布,這樣才能讓大家有規則可循,否則的話,各個團隊自行以多種說法來做宣告,不免會混淆視聽。
許次長銘能:我想針對個案在臨床試驗應該遵守什麼樣的……
王委員育敏:你們再去研議,好不好?
許次長銘能:我們再做研議。另外,我要說明的是,必須等到最後發給許可證時,衛福部才會宣布這件事,告訴大家它有沒有拿到許可證;至於中間的這段……
王委員育敏:但在此之前,如果任由研發團隊對外發布訊息,而且是以多種訊息來解讀,那麼消費者或投資者會不知所措。
許次長銘能:我們再跟金管會的相關單位研議,因為這是屬於影響股價的部分,對我們的專業來講……
王委員育敏:對啊!我們絕對支持生技產業的發展,但也不能放任有些人以不實資訊試圖混淆視聽或是欺騙投資者。
許次長銘能:是,謝謝委員。
王委員育敏:接下來我要請教中研院王副院長。副院長辛苦了!因為翁院長不在,所以很多事情需要你代勞,其實我們有很多問題要問的也是翁院長,副院長不一定了解實際狀況,但本席知道剛剛有一個最新報告,翁院長已承認有幫她女兒處理股票,而蔡英文主席也表示,她認為翁院長已經影響到中研院的聲譽,希望他可以自行請辭,並且應該要回國說明。
最近這一連串的事件下來,副院長覺得中研院本身的士氣和聲譽,有沒有受到影響?你個人有沒有感受到很大的壓力?
主席:請中研院王副院長答復。
王副院長惠鈞:主席、各位委員。我想一定會有影響,因為媒體大幅報導,不過各方面的批評也好、解釋也好,有一些並不是那麼正確,所以身為中研院的一分子,感覺當然不是那麼好。至於這裡面的很多內情,就像委員所言,只有翁院長知道,而他目前是從法律面來處理這件事,因此我們也沒有辦法著墨太多。
王委員育敏:中研院在民國101年8月14日訂定科技移轉利益衝突迴避處理原則,當時你在中研院嗎?
王副院長惠鈞:應該是。
王委員育敏:你有參與這個原則的訂定嗎?
王副院長惠鈞:細節我不太記得,但有可能,因為我那時還在中研院。
王委員育敏:這個原則明白規範關係人應該揭露相關利益,其中一個關係人的定義是指當事人之二親等以內親屬。因此,若以這次事件來看,翁院長的女兒持有股票,而且翁院長也代為操作,你認為翁院長此舉有沒有違反利益迴避的原則?有沒有涉及利益衝突?
王副院長惠鈞:我們的確訂有中央研究院技術轉移利益衝突與迴避原則,基本上,這是參考公務人員利益迴避法來訂定。這裡面有好幾條規定,因條文較長,我就不全部唸,僅就第三條第一項及第二項做個說明。這條條文提到所謂關係人,第一是指:「當事人之配偶與共同生活之家屬。」;第二是指:「當事人之二親等以內親屬。」,所以看起來,翁院長的女兒應該屬於這個規範,但是我們在利益迴避的揭露表裡面有個填表說明,也就是說,每個人如果要技轉,都要填寫兩張表,這裡我就舉出一項表內的註解:「二等親以內親屬範圍,包括祖父母、外祖父母、父母、兄弟姊妹、兄嫂、弟媳、姊夫、妹婿、連襟、妯娌、孫子女、外孫子女。」,其中並無子女,因為子女如果成年的話,已經獨立生活,所以不包含在這個填表範圍內,這是我們當初的規定。
王委員育敏:竟然漏掉「子女」這一項?
王副院長惠鈞:不是漏掉,因為……
王委員育敏:反而有「孫子女」……
王副院長惠鈞:子女是一等親啦!
王委員育敏:所以表格裡面沒有?
王副院長惠鈞:對。
王委員育敏:我們之後可能要好好探究這個問題,因為你說成年子女就是獨立個體……
王副院長惠鈞:因為沒有生活在一起。
王委員育敏:這可能跟一般民眾的認知和觀感有所衝突,之後我們再來探討這個問題。
最後,我要說的是,現在已經有中研院院士發起連署,並且送交倫理委員會,因為他們認為翁院長沒有做到利益迴避。我要請教,倫理委員會到底有何功能?可以發揮什麼樣的效果?這個連署案送交倫理委員會之後,最後會做出什麼樣的處置?這個處置有沒有任何行政上的效力?抑或只是形式上的審核,但不達成任何效果?我們知道,因為中研院是最高學術機構,所以包括立法院在內,也很少過度監督中研院的運作,完全尊重學術獨立自主,可是今天發生這起事件,本席要問的是,如果這起事件已經涉及利益衝突與迴避原則,中研院的倫理委員會會做出什麼樣的處理?
王副院長惠鈞:首先,我要澄清,對於這個連署名單及細節我不記得;不過,在中研院工作的人不一定是院士,就我所知,這些人大部分是文法相關的研究人員,並非院士。
其次,我們的倫理委員會當然會處理院內有關涉及利益衝突或違法之類的事情,並且做一些判決提供院內做為參考,如果是違法,我們會照法律程序送到相關單位去做處理……
王委員育敏:如果是違反這個原則呢?
王副院長惠鈞:有的會記過或是什麼之類的啦!至於將來若是違背這個原則的話,那就會送到我們院裡面,然後往上我們還有政風室等等,都可以去做處理。
王委員育敏:OK,謝謝副院長。
我要在此重申,我們對國內生技產業的發展都是支持的,只是希望在這個過程中,如果出現一些弊端或是不好的發展面向,大家可以共同監督把它糾舉出來,這樣才可以讓整個臺灣的生技產業邁開大步,繼而成為我們下一個明星產業。
主席:王委員,我想請王副院長再度上台,因為他剛才針對妳的問題,有些地方並沒有回答清楚。
林委員靜儀:(在席位上)可是時間已經到了。
主席:之前林淑芬委員擔任主席時也是這樣啊!要讓人家質詢完嘛!何況時間沒有超過很多。
吳委員焜裕:(在席位上)時間超過了,可以私下說明。
主席:我只是要問最後一個問題,因為這個問題王副院長應該要清楚回答,就是你說的二等親是不是含一等親?這在條文上要說明嘛!你們所填的表格裡面沒有寫出「子女」……
王副院長惠鈞:那個表上都已經說明了;對於細節,我們會後可以再釐清。
主席(王委員育敏):請副院長私下再回答這個問題。
王副院長惠鈞:好,謝謝主席。
主席:請洪委員慈庸質詢。
洪委員慈庸:主席、各位列席官員、各位同仁。今天我看過經濟部及衛福部這兩個部會的報告內容之後,有幾個問題想要請教。我想發展生技產業是藍綠共識,從扁政府到馬政府都投入了大量資源,同時不斷進行相關法規的鬆綁,目的就是希望營造一個最好的環境,讓我們的生技產業能夠起飛。所以我想請教經濟部及衛福部,就廣義的生技醫藥來看,現在我們1年的投資額有多少?產值又有多少?
主席:請經濟部工業局呂副局長答復。
呂副局長正華:主席、各位委員。以投資統計來講,我們今年投資了484.93億元,整個營業額是3,000億左右。
洪委員慈庸:在報告裡面我有看到這個數字。其實對於醫藥生技這一塊,政府一直想把它打造成一個兆元產業,所以以目前3,000億左右的產值來看,未來還有很大的發展空間。請問政府對於生技產業未來的整體戰略規劃到底是什麼?中期跟長期的目標是什麼?發展藍圖又是什麼?
呂副局長正華:因為生技產業開發期程較長、風險較高、研發經費投入較多,而且還有法規管制等等,所以為了推動產業,我們在生技新藥發展條例裡面特別訂有相關優惠做為鼓勵。根據立法院通過的生技新藥發展條例,我們對於新藥以及高風險的醫材都會給予特別鼓勵,事實上,我們除了要做好各部會之間的協調和合作之外,行政院也有一個統籌性的生技鑽石起飛方案,目的就是逐一推動這樣的產業發展,這幾年的成果確實已經開始陸續展現。值得一提的是,在產業轉型的過程中,生技產業是一項主力產業,它可以讓我們的產值往前推動,而這裡面當然就包括新藥的開發及相關藥品的研發,尤其是在醫材的推動上,可以結合資通訊電子的產業製造能力,所以它能發展得更好。
洪委員慈庸:剛才提到的產值目標,大概是以多久的時間達到什麼樣的產值?
呂副局長正華:去年我們剛好推動生物經濟發展方案,在這個方案裡面,我們每年都會召開所謂的VTC策略規劃會議,所以今年我們是如火如荼的把去年推動的生物經濟發展方案逐一去做規劃,產值部分也是逐年規劃,以目前3,000億來看,到了2020年,我們希望能夠倍增到7,000、8,000億左右,也就是我們是呈現逐年往上成長的推估,而且也會有相關措施。
洪委員慈庸:好。
衛福部許次長對於這個問題有何說明?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。有關這部分,站在衛福部的立場,第一,我們一定要建立一個非常好的法規環境,俾使業者在這個基礎上讓安全有效的新藥可以順利上市;當然,除了安全有效之外,同時它也要符合國際標準,畢竟臺灣市場較小,未來研發出來的新藥所付出的資本是非常大的,所以必須進入國際市場才能讓這個產業向上提升。第二,我們針對研發的業者或是臨床醫師,會提供相關的法規諮詢,而且是在剛開始時就提供明確的研發方向及法規要求,以免他們走冤枉路,到最後才發現法規不允許而產生很多錯誤的投資。換句話說,我們在法規諮詢及支持服務方面,會提供研發者更精確的資訊,而且不是只有國內相關資訊,我們還蒐集很多國際各個領域相關的新藥發展規範及資訊,提供給業者參考。
洪委員慈庸:好。
另外,眾所周知,我們的準總統蔡英文主席希望未來臺灣能夠成為亞太生技醫藥研發產業中心,據此我要請教,目前臺灣最大的優勢及所面臨的最大挑戰是什麼?
許次長銘能:臺灣最大的優勢就在於我們整個醫療品質在亞洲地區來講算是非常好的,所以我們的醫療體系就是建構在這樣的基礎之下,而且我們在這方面的人才相當多,包括很多臨床醫師,都有一些創新作為,這是我們非常大的利基。這是第一點。
第二點,我們要營造一個非常好的臨床試驗環境。事實上,各個國家都希望能夠擁有很好的生技產業,但這裡面有一個非常大的門檻,就是臨床試驗這一塊。如果臨床試驗能夠建立很好的基礎和品質,那麼很多新藥經由臨床試驗的程序,就能得到很好的發展,所以這是非常重要的,而且可以吸引國外大藥廠來臺投資新藥的開發,當然,在這個過程中,重點就是我們的臨床試驗環境有沒有符合世界標準。
洪委員慈庸:那我們現在遇到最大的挑戰和問題是什麼?
許次長銘能:我們現在最大的挑戰就是資金,因為這個產業必須投入龐大的資金,而且到最後很可能是失敗的,所以我們必須面對這樣的挑戰;還有,不論是創新或是結合高科技,我們都需要培育更多人才,所以這部分也需要投入更多資金,才能建立紮實的研發基礎。
洪委員慈庸:那呂副局長認為我們現在最大的問題在哪裡?
呂副局長正華:剛才我說明過,因為生技新藥的研發,不僅時間長,而且風險高,所以投入研發,需要人力的培育及資金的準備,尤其是新的產業需要時間慢慢去try,同時在try的過程中,還要承受不確定性和風險性,因此,有時會遇到一些狀況,好比最近討論較多的,有些新藥在各個研發階段時,可能有必要重新調整,像這類情況,我們就必須從產業發展的角度來給予各種協助。
洪委員慈庸:根據生技產業白皮書這份報告的分析,我們有一項很嚴重的劣勢就是學術研發和產業需要之間出現極大落差。請問這個落差產生的原因是什麼?我們要如何補足?
許次長銘能:我想學術和產業之間的落差必須透過更多的產官學合作跟整合來補足。其實我們現在有很多研發量能,但是,如何與產業接軌,當然可以透過許多技轉的方式、共同研發的方式來加強,譬如經濟部就有許多科專計畫就是結合學術以及產業,在彼此共同合作之下,發展出更多的新藥。當然,我們也可以建立政府的相關法律規範,促進產業與學術的合作。
洪委員慈庸:其實,這個問題還滿嚴重的,因此,本席希望兩個部會能夠多加研議。
最後,本席要請教金管會,從基亞到浩鼎的事件,到底我們有沒有創造出產值?或者只是讓一些人炒股票、玩金錢遊戲?接下來,我們要如何避免這些炒股票的人繼續糟蹋生技產業?我們要如何挽回投資人以及社會大眾對於生技產業的信心?
主席:請金管會證期局張副局長答復。
張副局長麗真:主席、各位委員。金管會也是配合政府的政策,協助臺灣生技產業的發展,因此,在上市上櫃方面是有生技股的相關規定,雖然是有一些豁免的條款,不過,後面的監理是比一般公司都更嚴格。以資訊公開為例,櫃買中心與臺灣證券交易所對它的資訊公開是要求比較多的。至於委員關心的交易面,我們的證券市場已經有一套監視制度,因此,有關公司在市場上的一些不法情況都會列入監視,而且我們也與檢調單位有密切的配合,謝謝。
洪委員慈庸:謝謝金管會的說明。本席看過你們的報告,內容寫得洋洋灑灑,提到往後會加強管理、抽查是否有公開資訊,同時也會加強查緝不法,問題是你們到底查了哪些不法?不要每次都等到發生事情後才要開始查,這樣不會有投資人敢再投資生技產業,關於這個部分要請金管會多加留意。
張副局長麗真:是,謝謝。
主席:接下來輪到陳委員曼麗質詢,在陳委員質詢完畢之後,我們就休息5分鐘。
請陳委員曼麗質詢。
陳委員曼麗:主席、各位列席官員、各位同仁。雖然本席並不是學醫的,但是對於這個議題也是非常的關心,因為大家都很希望我們的生技產業能夠起飛。在今天的簡報中提到,104年核准的新藥申請總共有170件,然而,去年核准上市的卻僅有2件,由此可知,從開始申請一直到上市,還有相當大的距離,不知衛福部的長官認為這部分的成果是好或不好?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。剛剛已經提過整個新藥的發展相當冗長,而且變數非常多、風險也非常高,不只是臺灣,世界各國在新藥開發的部分,一開始都有非常多申請的案子,但是,最後能夠成功的都只有少數。
陳委員曼麗:所以我們可以看到臺灣目前有許多方案正在進行,但是,感覺上是花了很長的時間,卻無法獲得令人振奮的效果。我們當然很期待有新的藥、新的試劑、新的醫療策略甚至是新的醫材,讓臺灣在這方面能夠做得更好,但是,感覺上,這方面的成果似乎無法令人感到振奮,好不容易看到了一點點曙光,最近卻好像又被打趴了,看來產業的發展並不是一般人想像的那樣單純。
看到昨天蘋果日報的報導,本席認為,其實媒體也扮演了非常重要的角色,因為它能把一些問題以民眾能夠理解的言語來陳述,本席也相信許多人都看過這篇報導。目前臺灣的C肝帶原者大約超過50萬人,然而,美國的新藥相當昂貴,因此,像印度、孟加拉就自行研發了C肝的藥品,但是,它可能只是學名藥,不過,在價格上就比美國便宜許多,所以臺灣有些C肝患者就會請人從國外代購進來,請問,這樣的行為是否合法?
許次長銘能:根據藥事法的規定,針對某些病人需要某些特殊藥品,可以採用專案許可的方式,以購買相關的藥品,因此,他們也是依照藥事法的相關規定去做。
陳委員曼麗:也就是說,患者必須以專案的方式提出申請?
許次長銘能:對。
陳委員曼麗:目前臺灣是否有像印度、孟加拉那樣的能力,足以自行研發學名藥?目前臺灣的能力是否已經到達那樣的程度?
許次長銘能:關於臺灣發展學名藥的部分,確實是有這樣的能力,但是,這個藥品還是在專利期的狀況下,即使製造出學名藥也是無法上市,因為會侵犯到人家的專利。
陳委員曼麗:如果是站在衛福部的角度呢?也就是說,我們希望能讓國人使用便宜又有效的新藥,不知道衛福部對於國內生技業的發展是否有一些前瞻性的規劃?或者有一些需要疏通的瓶頸?即是否有類似這樣的環節?請次長現在提出來讓我們有所了解。
許次長銘能:第一個是關於專利的部分,畢竟投資了許多的時間及金錢,一定要法律給予相關的專利保障,因此,通常都是在專利期過了之後,我們臺灣的藥廠才能依照該藥品取得相關的原料去發展新的學名藥,當學名藥上市之後,原廠的藥價就會往下降,市場的模式大致就是如此。
陳委員曼麗:我們有一些正在進行的鼓勵措施嗎?
許次長銘能:目前我們對於學名藥的部分有一個審查的相關程序,而這個程序一直到學名藥審查的過程已經被簡化了。
陳委員曼麗:接下來,本席要問的是關於藥害的救濟,就本席所知,衛福部正大力的推動HPV疫苗,也就是子宮頸癌疫苗,但是,在日本338萬名施打過的女性中,有2,584人產生了副作用,症狀是全身疼痛、發麻、視力弱化等,不知道在臺灣施打過的人會有什麼樣的反應?本席從官方的系統中得知,臺灣並沒有這樣的狀況,不過日本的確已經有12名受害者將向日本政府以及廠商提出求償,雖然臺灣官方表示沒有這樣的狀況,也不知你們的根據是否確實,還有,你們是否有做過調查?是否有因應這種狀況的準備?
許次長銘能:我們對於新藥品上市都有做相關不良反應的監測。
陳委員曼麗:所以臺灣是沒有嗎?
許次長銘能:有,臺灣有監測這項藥品的反應,目前我們收到的通報大約有146件,但是,這146件都不是……
陳委員曼麗:146件?我們已經施打了多少人?
許次長銘能:關於施打疫苗的詳細內容,可能還需要查詢一些相關的資料。
陳委員曼麗:目前提出有不良反應的總共有146件?
許次長銘能:不過,根據我們進一步的分析,那些不良反應大部分都是暈針或局部注射疼痛,至於日本發生的那些症狀,我們也會就那些現象……
陳委員曼麗:我們施打的是和日本相同的疫苗嗎?
許次長銘能:目前臺灣有2家廠商、有2件這樣的產品。
陳委員曼麗:希望你能將相關資料提供給本席?
許次長銘能:好。
陳委員曼麗:再來是關於藥品回收的部分,在藥品發展出來之後,接著就會有許多人開始使用,然而在使用之後,剩餘的藥品究竟是回收到哪裡?以新北市為例,根據他們的調查,大約有四成的民眾會將吃不完的藥直接丟進垃圾桶或是隨便亂丟,因為藥品的體積可能都很小,但是這點令我們很擔心,有些藥品可能含有抗生素或是內分泌的干擾物質,如果這些東西流入河川、土壤,將會對自然環境造成傷害,甚至是生態也會受到影響,譬如環境賀爾蒙可能就是這樣連帶的牽扯。不知道衛福部對於這些藥品回收的追蹤,是否有像新北市那樣做過研究?根據你們的統計,回收的數量到底有多少?它所占的比例是多少?
許次長銘能:關於回收的部分,現在是由各縣市的藥師公會及各縣市的環保單位共同合作。
陳委員曼麗:但是,中央主管機關應該要有一個最後的總數。
許次長銘能:我們已經在蒐集相關的資料,包括其他各國對於家庭廢棄藥品的處理現況等,希望能建立一套比較一致的作法。現在的問題是這些收回來的藥品要集中、要由環保單位進行焚燒,不能以倒入河川或沖入馬桶的方式處理,這也是我們目前一直呼籲民眾注意相關藥品處理的……
陳委員曼麗:你們是否有一些相關的研究,讓我們可以確認中央主管機關也在做這方面的努力,否則,我們真的非常擔心恐怕有4成的藥品都已經流入了大自然?
許次長銘能:因為會流入大自然,所以我們會與環保署針對這個部分……
陳委員曼麗:希望你能將相關的資料提供給本席,因為本席實在是很擔心!
許次長銘能:好。
陳委員曼麗:再者,衛生福利部的管轄業務也包括食品在內,至於食品的管理是採用有效日期的方式,剛才本席談的是藥品的丟棄,現在則是關於食品的丟棄,根據媒體的報導,四大超商每天報廢的鮮食平均大約有兩成,足以養活5,000頭豬,其中有些可能是過期品、有些可能是快要過期就被下架,大致就是食品、蔬果或鮮食之類的東西。一般來說,這有4種處理方式,包括退回給原廠商、員工自行消耗、找清潔隊或廚餘回收業者,基本上,第三、四項是由環保署管理,但是,衛福部可曾針對第一、二項進行過統計,是否真有這麼大的量被拋棄,而這些東西就造成了剩食的問題?其實,在國外大家都會重視食品必須充分被使用,畢竟每樣食品都是得來不易,不知衛福部對於這些過期品或即將要過期的食品是否有做過管理?
許次長銘能:過期的食品當然是要銷毀,在整個銷毀的過程中,有些廠商就會退回原廠去做銷毀……
陳委員曼麗:你們是否曾針對這個量做過統計?
許次長銘能:我們會就查訪的過程中去了解整個回收的量,再來進行相關的評斷。
陳委員曼麗:根據媒體的查訪,他們估算的量是兩成,如果真是如此,確實是相當可怕。
許次長銘能:20%的量確實是相當大。
陳委員曼麗:因此,本席希望衛福部能夠針對這個部分進行研究調查。
許次長銘能:我們可能針對即期品的部分,透過更多管道……
陳委員曼麗:大概需要多久的時間?
許次長銘能:是否能給我們1個月的時間?
陳委員曼麗:那就1個月,非常感謝!
主席:現在休息5分鐘。
休息
繼續開會
主席(陳委員宜民代):現在繼續開會。
請鍾委員孔炤質詢。
鍾委員孔炤:主席、各位列席官員、各位同仁。本席在這邊要特別請教次長,整個早上這樣聽下來,包括媒體對於生技新藥提出的不同看法與見解,以及中研院的翁院長是否違反利益迴避等等的問題,其實,本席認為,衛福部底下的國衛院所扮演的角色非常重要,因為國衛院也處理生物科技的部分,所以你們整個業務範圍涵括得很廣,但是,同樣都是研究院,位階卻不太一樣,你們似乎比較「細漢」就對了?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。各有不同的任務。
鍾委員孔炤:各有不同的任務與政策嘛!基本上,前年已經通過的長照法接下來就要準備推動,而國衛院本身就有一個老人健康醫學中心,對嗎?
主席:請衛福部國衛院江主任秘書答復。
江主任秘書宏哲:主席、各位委員。老人醫學研究組,現在正在籌畫。
鍾委員孔炤:未來是否會與長照結合在一起?
江主任秘書宏哲:是的。
鍾委員孔炤:國衛院原本就是為了國民的健康福祉而設立,既然事涉國民的健康,也牽扯到未來臺灣人口的老人化,相對的,國衛院所扮演的角色就非常重要,因此,你們要提供衛福部許多相關的政策、看法及見解,未來在推動長照的時候能有一些準則及方向,並且讓未來的政策更能夠推動,無論是在人力或經費上,國衛院都應該展現出這幾年努力的成果,剛才你也提到這兩年已經開始籌劃設立,是嗎?
江主任秘書宏哲:是。
鍾委員孔炤:相對的,應該會有一些目標及方向,主秘是否能提供一些意見及見解,讓我們大家共同參酌一下?
江主任秘書宏哲:謝謝委員的支持!過去國衛院是以老人醫學研究組在運作,而老人醫學研究組主要分成幾個部分,第一個是老人健康的長期追蹤,試圖找出如何活化老化的指標,而這些東西也都會轉變為政策。這幾年衛福部及立法院都一直期待國衛院老人醫學研究組能夠成為一個研究所或研究中心,部長在上個禮拜也指示先成立一個中心,未來長期朝向獨立研究單位的方向進行,而且在這個研究所中也會加入老人社區照護的部分。
鍾委員孔炤:謝謝主秘。本席認為,對於未來長照的推動或未來臺灣老人化之後的協助與幫助,高齡與健康的整合研究中心扮演的角色相當重要,因此,面對後續相關的人力或經費,無論換新政府之後是誰擔任部長,次長,由於常務次長是事務官,所以你一定還會留任,現在是否能提出你的看法或見解,如何協助國衛院在未來政府推動的長照政策中扮演更為重要的角色?
許次長銘能:長照推動這麼久以來,還是有許多的困境要面對,尤其是照顧人力不足以及社區照顧的發展,這兩者非常的重要,未來基金經費有限的狀況下,社區照顧更應該要凸顯它的功能,因此,許多相關的研究或政策的方向都要仰賴團隊進行長期的追蹤及研究,甚至關於實務介入模式的資料蒐集與長期的探討也是有必要的,所以我們未來會提出相關政策額度的研究計畫,爭取科技部將相關的經費挹注國衛院,以提供更多的方向。同時,我們也希望社家署、照護司以及醫事司都能提出相關政策,在推動過程中與國衛院進行更好、更密切的合作。
鍾委員孔炤:無論是衛福部、科技部或經濟部,其實,大家對於未來的長照政策都應該要一起合作,不能讓衛福部單獨一肩扛,應該透過政府部門之間的橫向聯繫,包括資金的來源與相關人力的配合,如此才能對國民健康福祉有所幫助。
許次長銘能:是。
鍾委員孔炤:這個福祉不只是針對老人,對於一般民眾也都有幫助,本席認為,這是當初成立國衛院最終的宗旨及目標,因此,我們期待國衛院能夠多用心、能夠進行更好的政策研究,進而將你們研發的成果讓所有的民眾分享。
本席在此也要特別告訴次長及主秘,本席與陳宜民委員在上次會議中已經提過,我們希望能在南部尤其是高雄,成立一個熱帶疾病防治中心,當時蔣部長也同意列入考量,未來在訂定政策時會以高雄為優先。無論是國衛院或衛福部,你們應該都很清楚,臺灣本來就位於亞熱帶,氣候炎熱潮濕,高雄的氣候更是如此,像登革熱肆虐於臺南、高雄及屏東等地。事實上,與臺灣的北部相比,南部確實是有先天的環境劣勢,也因為如此,針對登革熱的疫情,在高雄醫學院設有防疫中心,陳宜民委員出身於高醫,他對這個部分也相當清楚,但是,該中心的規模不大,而且它的資源也是有限。如果能夠透過衛福部與國衛院的全力協助及支持,讓既有的研究基礎更加擴大,絕對會比再選擇一個新地方更為便利,在時效及效益上也都會更快速。坦白講,高雄市政府對於這個部分都已經準備好,而且上星期國衛院及衛福部都有派人過去勘查,無論是現場的場地或人力,主秘,你也有去吧?
江主任秘書宏哲:我沒有去。
鍾委員孔炤:他們勘查回來之後,應該也有向次長提出報告?
許次長銘能:是。
鍾委員孔炤:次長,是否能讓這個防疫中心透過產學合作,提升熱帶疾病醫學的能量,同時朝生技的研究發展,有助於疫苗的研發,包括生技人才的培訓,還有本席非常關心的就業問題,次長,你是否能針對這個部分提出回應?
許次長銘能:我們都非常關心南部相關傳染病的狀況,尤其是蚊媒導致的傳染病,在行政院鍾政委的協調之下,已經決定在國家衛生研究院下成立一個蚊媒傳染病防治研究中心,不過,這個研究中心應該還是會設在南部,目前已經勘查了一些相關的場所,最後還是要行政院邀請相關政府單位討論後再決定。
鍾委員孔炤:不只是蚊媒,應該是熱帶疾病的防治中心。
許次長銘能:我知道,之前就有一個熱帶疾病防治中心設置在高雄。
鍾委員孔炤:熱帶疾病防治中心比蚊媒傳染病防治中心更重要,因為它包含了像是瘧疾等等的亞熱帶地區傳染病在內。
許次長銘能:是。
鍾委員孔炤:關於這個部分,請次長能夠特別列入考慮,誠如本席剛才所言,高雄市政府已經準備好,高醫也已經準備好,應該要讓這個最有效益的方式能夠呈現出來,同時也能夠最快看到成果,因此,也請次長能夠針對這個部分再做考量。
許次長銘能:好,謝謝。
鍾委員孔炤:最後,本席要利用短短的1分鐘特別就教於次長,本席知道國衛院員工有籌組工會,其實,出身於勞工的本席對於工會的發展相當關心,剛剛休息時間也與次長稍微討論過,是否讓國衛院的工會也能夠參與董事會?
許次長銘能:事實上,國衛院勞工工會爭取參與董事會已經有相當長的一段時間,我們也了解他們的一些相關訴求……
鍾委員孔炤:次長,現在本席不是要求修正條文,而是就衛福部現行的條文規定,是否能夠先行考量,讓工會內部自行研議推派代表,讓他們在15席的董事席位中先佔有1席的勞工董事,未來再逐步進行修法?最快速的方式就是讓勞工工會參與你們由專家學者及內部成員所占的15個席位,這樣工會也能夠參與經營的管理權,其實,這個作法對於勞資雙方的互動非常有幫助。
許次長銘能:關於這個部分,我們會尊重委員的意見,針對如何推派相關代表或是進入董事會相關的部分……
鍾委員孔炤:本席的想法是在尚未修法之前……
許次長銘能:在尚未修法之前,請國衛院再找工會相關的……
鍾委員孔炤:其實是可以運用行政作為去處理,不必再等到修法。
許次長銘能:是。
鍾委員孔炤:如果要等到修法,只怕到時候大家又要為了修訂為幾分之幾等等的問題而爭議不休,因此,本席建議現在先讓他們推派一位代表進場熟悉整個狀態,未來再逐步進行修法,這樣做是否可行?
許次長銘能:關於這個部分,我們再來研議,並請國衛院再邀請工會一起討論。
鍾委員孔炤:謝謝次長。
主席:請吳委員玉琴質詢。
吳委員玉琴:主席、各位列席官員、各位同仁。昨天蘋果日報用兩大版面討論C肝的藥品,現在本席就兩個部分與衛福部提出討論,因為本席認為有一些疑慮需要釐清。C肝的新藥上市後吵得沸沸揚揚,媒體也用非常大的篇幅報導,本席不知道它的報導是否能讓民眾確實了解這個狀況,不過,畢竟衛福部是專業,請問它的價值到底有沒有被誇大或是被高估?就像過去婦女吃的更年期賀爾蒙補充藥品,現在已經發現有導致乳癌的風險,而且日本也發現三百多萬人施打子宮頸癌疫苗後有兩千多人出現問題,甚至最近還有12位年輕女性打算與藥廠打官司,也就是說,所有的藥物還是會存在著風險,因此,雖然衛福部已經核定這個C肝新藥7張藥證,到底它有沒有風險?到底它是否真的有這樣的價值?治癒率真的可以達到82%至92%,甚至是達到97%嗎?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。食藥署是針對這個藥品安全有效的部分進行處理,至於是否達到安全有效的標準,等一下再請食藥署的同仁再向委員提出說明。究竟這個藥是否達到那樣的療效,或是它到底有沒有那樣的價值,就要回歸到市場的機制,至於食藥署管理的部分,則是針對它是否安全有效達到可以上市的標準,假設它未達安全有效的標準,我們也不會讓它上市。一旦上市之後,市場對它的定價如何,必須要回歸到市場去處理,至於現在它要申請健保給付的部分,也是有健保的相關程序要走,等一下再請李副署長向委員說明。現在是否請CDE的醫師代為說明,當初審查時所提的效果以及它的科學數據?
吳委員玉琴:它應該是有效,不然,也不會讓它通過,是嗎?
許次長銘能:對,一定是有效。
吳委員玉琴:它應該是有一定的效果,只是,現在討論的是它的訂價非常高。其實,B肝與C肝的不同點,在於B肝有疫苗可以施打,大約從1984年開始,我們就全面針對嬰幼兒施打疫苗,未來的狀況應該會好一點,但是,目前B肝的口服藥只能達到控制的效果,不一定能夠完全治癒,然而,這次的C肝新藥卻是把療程完整做好即可痊癒,感覺上好像非常有效,而且彷彿看到了希望!真的確定是如此嗎?
許次長銘能:確定,它在臨床的驗證過程中,其實是有相關的數字可以見證,即經過一個療程之後是可以治癒的。
吳委員玉琴:本席要請教健保署,事實上,許多的患者根本就吃不起這個藥,如果沒有健保給付的狀況下,他們確實是付不起這個藥費,一個療程要兩百多萬,一般民眾是吃不起的,因此我們必須思考一個問題,究竟健保要不要給付?事實上,其中涉及的問題非常複雜,因為本席過去曾經在健保會擔任3年的委員,非常了解整個過程的複雜,不過,本席還是要與健保署做個討論。以B肝的藥品為例,大概都是占所有藥品費用中的第一位,一年需要將近20億的費用,卻還未必能夠治得了,但是,現在的C肝卻已經有藥物可以治癒,兩相比較之下,到底哪一種藥是值得的?更何況,B肝的藥物可能要吃一輩子吧?
主席:請衛福部健保署李副署長答復。
李副署長丞華:主席、各位委員。根據目前C肝藥物的臨床試驗報告,它確實是可以將病毒清除、可以治療,但是,它並不像B型肝炎會讓人體產生抗體,因此,這些人還是有機會再度感染,也就是說,雖然可以治癒,若再接觸病毒還是有可能感染。目前臺灣有3家藥廠拿到4張許可證,並且向健保提出申請,的確,國際上的藥價差距非常大,在美國一開始時一個療程需要8萬塊美金,後來9月份在韓國是賣9,000塊美金,12月份在埃及甚至只賣900塊美金。
吳委員玉琴:其中的差異簡直是天壤之別。
李副署長丞華:大約是100倍的差距。
吳委員玉琴:對啊!
李副署長丞華:目前這3家藥廠向健保署申請的價格,大概是從33萬到164萬,我們會按照健保法第四十一條提到共同擬定會議中進行審議。
吳委員玉琴:本席曾經擔任健保會的委員,其實也很清楚,以血友病這類的疾病為例,平均每位患者一年大約要花418萬,而罕見疾病患者一年平均要花43萬,其實,健保會中有許多委員都喊貴,也都認為應該要檢討,但是,這是救命的藥,以本席長期在民間弱勢團體服務的立場而言,本席是極力支持對於弱勢者的救治。坦白講,沒有人是願意生病的,更何況有些藥可能是長期要吃一輩子的,從這個角度來看,雖然目前這個藥確實很貴,如果它真的能夠治癒,或許會像李副署長所言,以後病毒可能會再出現,以及未來可能會有抗藥性等等,這些本席都不知道,因為目前的報導並沒有提到往後的抗藥性問題,但是我們應該討論的是要不要納入健保。剛才本席之所以提出那些罕見疾病的例子,並不是說罕見疾病不要救或血友病不要救,事實上,這些疾病都要救,只是,這些C肝病患到底要不要救,其中的評斷標準,你剛剛也有提到,目前並不是很確認,因為還在談價格,也就是說,已經列入考慮只是還在談價格?
李副署長丞華:根據估計,需要治療的病患人數大約是20萬至60萬之間,如果每位病患的治療費以33萬計算,乘出來的數字對於健保財務的衝擊確實相當大。
吳委員玉琴:這也是接下來本席要問的財務衝擊的問題。
李副署長丞華:因此,去年健保會討論要降低費率時,我們持高度保留的態度,事實上,有許多新藥、新科技會用掉非常多錢。
吳委員玉琴:是。
李副署長丞華:在藥品共同擬定會議討論完之後,如果結論是對於財務的衝擊很大,我們就會提交健保會,讓健保會討論這個財務衝擊是否會導致下一年度的總額及費率必須進行調整。
吳委員玉琴:如果一個人是三十幾萬,而病患的數量又如此龐大,從報紙的報導得知,你們10年要編列800億,初估下來,一年大概需要80億左右,至於剛才你說會提到健保會討論,本席相信醫界會第一個跳出來反對,因為新藥會占掉它的總額,對此,本席也不知道到底要怎麼辦?事實上,過去在我們的討論過程中,如果要將新藥放在總額中,醫界總是第一個跳出來反對,因為這樣會吃掉它其他的預算,所以是否有其他的策略呢?以B肝的藥物為例,本席記得它早期是使用專案的方式處理,因為它確實是一筆很大的金額,必須要很審慎的評估,不知道健保署有什麼樣的考量?
李副署長丞華:如果我們能夠爭取到接近埃及的藥價,這樣對於財務的衝擊就會很小,如果我們要付的是與韓國一樣的價格,這樣對於財務的衝擊就會很大,如此一來,健保會中的醫界代表確實會持比較謹慎的態度。
吳委員玉琴:不是謹慎,而是反彈。
李副署長丞華:但是,共同擬定會議中也有消費者代表及勞工代表,既然有多元的聲音,大家就能夠充分討論,也許能夠妥協出一個大家雖不是很滿意卻能互相妥協的平衡方案,因此,我們會朝這個方向去努力。
吳委員玉琴:如果要納入健保給付,大概需要多久的時間?
李副署長丞華:如果價格夠低的話,應該就會很快。
吳委員玉琴:我們就拭目以待,看看健保署將如何處理。其實,這則報導中還有一個環節,剛才次長也有提到,如果是自用的話,向食藥署提出申請之後,可以直接向國外購買,而且印度的藥比較便宜,因為它是以開發中國家的名義用便宜價格製作學名藥,問題是代理買賣藥品到底合不合法?食藥署或衛福部到底如何管理這群人?
許次長銘能:關於代理買賣的部分,理論上,我們的程序要由當事人提出申請,必須先取得醫師的診斷書及處方簽,再向食藥署提出申請,由食藥署核定這個藥是否能夠進來,至於代理的相關法規,是否能請姜署長向委員提出說明?
吳委員玉琴:如果是由別人從國外買回來,應該要如何處理?
主席:請衛福部食藥署姜署長答復。
姜署長郁美:主席、各位委員。關於代辦的手續,之前在恩慈療法的部分已經有非常多的案件,我們都是由藥商做這方面的代辦手續。
吳委員玉琴:但是,現在藥商是在國外?
姜署長郁美:國內也有許多藥商可以幫助民眾、醫師或一些專案進行代辦手續。
吳委員玉琴:聽起來有點怪怪的!現在許可的藥證只有7張,既然國內有新藥的許可,卻還允許國人到印度、孟加拉買便宜的藥,到時候我不知道藥商會不會來告你們;但我知道他們因為需要才去這樣做。
姜署長郁美:是。民眾在得到我們的核准之後,一定會有代辦者──可能是在印度的公司或是國內的公司幫他們處理這方面的手續。所以一定要申請核准之後,才可以去辦。
吳委員玉琴:一年有多少件?
姜署長郁美:據我們的統計,上個月(三月份)是最高潮有29件;去年5月到現在為止,平均一個月是20件。
吳委員玉琴:問題是這些代辦者還是有很大的利差,他還是會索賄50萬,這中間還是有圖利的情況。本席認為這個部分,你們應該要查,不應該放任代理人牟取暴利,剝削病人。
姜署長郁美:這幾天,我們同仁也都在查網路上或在其他行銷手法上,是不是違反藥事法的規定。
吳委員玉琴:你看報上的標題寫著「政府失職」,所以我覺得我們應該加緊處理。程序合法的部分就要讓病人拿得到藥,不合法的部分就要去查,因為這裡面有部分是暴利。
姜署長郁美:謝謝委員。
主席:請李委員彥秀質詢。
李委員彥秀:主席、各位列席官員、各位同仁。上星期在審查國衛院相關基金預算時,本席對其中一筆預算有意見,也提出很多質疑。本席看到你們今年出了16種新藥,你們跟民間合作,也有一些權利金的交換,花了16億的研究經費,卻只拿回4,000萬的權利金。請問江主秘,我們與民間合作、產學合作或技術轉移時,有沒有相關的利益迴避規範?
主席:請衛福部國衛院江主任秘書答復。
江主任秘書宏哲:主席、各位委員。有的,國衛院有一個利益衝突管理要點。
李委員彥秀:有關權利金及利益管理要點,是規範內部的相關資料,你們可以公布嗎?也就是每一個技術合作結束之後,你們跟廠商、業者拿了多少權利金,本席看到的是一個總數,我們每年花16億研究經費,結果你們只拿4,000萬權利金,本席認為這個數字好低。你們合作之後,內部的管理規範包括權利金金額等資訊,是可以揭露的嗎?
江主任秘書宏哲:這部分是由我們的技轉中心來做全院的管理,根據國衛院相關管理要點的要求,所有發明人或計畫主持人……
李委員彥秀:主秘,本席的時間不多,請簡短回答我。我們花16億的研究經費,你們只拿回4,000萬的權利金,如果我現在想知道每個合作案拿多少權利金,與哪家廠商簽約等有關的規範,哪些資料是可以公布的?
江主任秘書宏哲:報告委員,簽約金與里程碑的權利金有一點點區別,前者會比較高一點,因為它是分年分次去……
李委員彥秀:對於相關的利益衝突,你們的揭露書與中央研究院的利益揭露表是否一樣?你們要不要把二等親填進去?子女部分是否也在規範之內,要不要填進來?
江主任秘書宏哲:要。
李委員彥秀:可是你們提供的這個表,對於成年子女要不要填進去,我沒有看到。
江主任秘書宏哲:要,我們在第三點規定配偶或共同生活之家屬及二等親以內,包括一等親、二等親都需要填。
李委員彥秀:所以是需要填進去的,謝謝江主秘。
中央研究院就在我的選區裡面,我一直很高興可以跟中研院當鄰居,有關中研院技術轉移揭露表,副院長剛剛在回答其他委員詢問時說你們不需要填二等親的表格,是不需要填,還是它已經包含在裡面?
主席:請中研院王副院長答復。
王副院長惠鈞:主席、各位委員。這個表格是我們的法務單位建立的,第一個是當事人、配偶及共同生活的人,至於二等親部分……
李委員彥秀:要不要填進來?
王副院長惠鈞:為了讓填表人更清楚,到底什麼人包括在二親等,就像我剛剛提到的那些人,的確是沒有包括子女。
李委員彥秀:所以這部分就與國衛院有很大的差別。經過這件事情之後,副院長認為二等親要不要填進去?
王副院長惠鈞:我們回去之後會與我們的法務檢討這個部分,看看……
李委員彥秀:本席認為,這整件事情,應該把中研院和翁院長切開來看,因為它對中研院的傷害實在太大了,對臺灣未來在生技產業的投入及國內外投資人的信心的傷害也很大。
王副院長惠鈞:這個我同意。
李委員彥秀:翁院長從95年上任至今,總共有72個技術轉移合作案,有關簽約金額、權利金等資料,你們今天說沒有辦法提供,我也尊重;問題是,納稅人繳了那麼多稅,每一年從總統府撥出那麼多預算給你們,每個合作案究竟拿回來多少錢、如何合作等等,我們完全看不到相關資料,在相關規範裡面居然漏掉這一筆,真是讓人匪夷所思。從翁院長上任以來,這72件究竟有沒有填過相關的表格?
王副院長惠鈞:委員指的72件是中研院全部還是只有翁院長的部分?
李委員彥秀:翁院長從95年上任到現在,有72件技術移轉……
王副院長惠鈞:我想每一個案子都有填表……
李委員彥秀:但是二等親內的子女因為不在表格之內,所以就不需要填?今天早上,翁院長寫了一封信,說他願意接受中研院倫理委員會的調查,您剛才說這個之前是其他的研究員寫的,不是院士寫的,所以這個部分委員會可能還不能成立。今天翁院長自己……
王副院長惠鈞:不是,我必須釐清,我們有一個倫理委員會,它原本就在那裡。誰要提出一個案子……
李委員彥秀:不管是利益衝突或是倫理委員會,如果翁院長本人願意接受調查,你們能否立即召開?
王副院長惠鈞:我的了解是已經有人提案,已經在進行中;但是我不知道細節。
李委員彥秀:在浩鼎案之後,我認為民眾對翁院長上任後的這72件合作案,究竟有沒有確實做到技術轉移利益迴避的要求,大家心裡是有問號的;特別是之前翁院長到文科研究所訪視時,說了哪些是可以申請專利的這樣的話,被很多人認為現在的中研院是銅臭味十足。最高學術單位的翁院長在訪視文科研究所時,竟然問了有哪些技術可轉移。此事若是真的,可是會讓中研院蒙羞。你們回去之後,要不要將這72件技術轉移合作案,包括在利益迴避揭露表裡面,沒有迴避子女的部分,好好查清楚?外界現在看到的,翁院長似乎有牽涉到利益迴避的問題,未來或許還有法律上的刑責;我們現在要問的是這72件究竟還有沒有問題?
王副院長惠鈞:一、我剛剛接到的資訊是那72件是我們全院的,不是翁院長……
李委員彥秀:我知道是全院,但是對每個技術合作案,能否合作、要跟誰簽約、拿多少權利金是你們內部的討論,沒辦法提供給我們。但翁院長他有一定的角色在裡面,對不對……
王副院長惠鈞:因為與業界有一些保密協定……
李委員彥秀:這些我都尊重;我的意思是能否合作、最後決定多少權利金,這是院內最後開會討論,在這72個案子拍板定案時,翁院長絕對有他一定的角色……
王副院長惠鈞:翁院長對每個案子並沒有什麼特定的角色,因為我們還有一個管理委員會去討論每一個案子技轉相關事宜。
李委員彥秀:最後院長還是要蓋章核定,對不對?
王副院長惠鈞:是啦!你如果要……
李委員彥秀:所以我說他有一定的角色在裡面。
王副院長惠鈞:但是我們也有一定的程序在進行……
李委員彥秀:但他還是有一定的角色在裡面。
王副院長惠鈞:是,是。
李委員彥秀:對於翁院長這位科學家,我是絕對尊重,但是在浩鼎解盲案記者會裡面,他是代表院長、代表他個人、還是代表科學家?他是用什麼樣的角色去參加,本席都有問號。回頭來看這72件技術合作案子,翁院長在裡面是舉足輕重的角色,還是他的手伸進去多少?我想民眾心裡都有很多的問號。本席一直對中研院也有很深厚的感情,因為我就在中研院旁邊長大……
王副院長惠鈞:我也常常從委員的辦公室前面走過……
李委員彥秀:為了中研院的聲譽,翁院長自95年上任以後,這72件或許完全沒有問題,但本席還是希望你們回去之後,趕快查清楚,讓中研院恢復它應有的聲望。不過,本席還是要說,國衛院有二等親的利益迴避表要填,為什麼中央研究院翁院長在制定技術轉移利益迴避表的時候,就不需要填?這件事情真的非常奇怪!
王副院長惠鈞:他在聲明書裡面也講了,他願意接受調查,就讓調查來釐清這件事情。
李委員彥秀:此事讓本席覺得很遺憾,本席認為中研院應該儘速與翁院長切割開來,將翁院長上任之後所有技術轉移案查清楚,還有後續要怎麼辦,包括利益衝突會議要怎麼召開,翁院長可能會說,因為利益迴避表沒有要他填二等親,所以他女兒持有這些股票是沒有問題。我不知道刑責上會不會有問題,但是在道德上,他有嚴重的瑕疵,你們訂定的利益迴避辦法是有瑕疵的。
主席(李委員彥秀代):請陳委員宜民質詢。
陳委員宜民:主席、各位列席官員、各位同仁。請問梁特聘研究員之前是不是也負責中研院技轉事宜?
主席:請中研院梁特聘研究員答復。
梁特聘研究員啟銘:主席、各位委員。是。
陳委員宜民:我們延續剛剛的問題,其實在中央研究院技轉利益揭露表裡面,它談到的就是關係人,在這個表格裡面當事人就是配偶或共同生活之家屬,另外就是當事人之二親等以內的親屬。請問二親等以內是否也包括一親等?
梁特聘研究員啟銘:當初這個表格設計是由我們的法務去寫的,因為怕有人不曉得,所以就將它明列出來……
陳委員宜民:這就很奇怪了!請問江主秘,國衛院有將二親等的這些人,用正面表列出來嗎?
主席:請衛福部國衛院江主任秘書答復。
江主任秘書宏哲:主席、各位委員。要點裡面沒有正面表列,但在執行上,我們都有照做。
陳委員宜民:對嘛!就法律定義來看,二親等內其實就包括一親等,當然也包括子女。中研院對二親等內以正面表列的方式,列出孫子女、外孫子女,他們不就是女兒或兒子生下來的,你們列出兒子、女兒生出來的孫子女、外孫子女,卻不列兒子、女兒,這不是很奇怪嗎?你們的法律諮詢,腦筋好像不太好,竟然將一親等漏掉。
既然有這樣的漏洞,你在中研院負責技轉表格的設計,有沒有什麼樣的措施可以馬上補正?因為下面列出來的東西並不是條文內的,是你們自己的解釋,是不是可以馬上改過來,還是得再經過法律顧問?
梁特聘研究員啟銘:跟委員報告,因為我已經從這個職位退休……
陳委員宜民:我知道,但是以你的common sense,能不能跟我講一下?
梁特聘研究員啟銘:我認為既然是這樣的話,應該可以趕快補救。
陳委員宜民:回去之後可以跟吳秘書長還有副院長報告,馬上糾正過來?
梁特聘研究員啟銘:應該是可以。
陳委員宜民:其次是就學術倫理的部分,我們上次曾行文中研院,要求學術倫理委員會的名單,可是你們說這是機密文件,不能告訴全國。請問江主秘,國衛院的學術倫理委員會名單可否公開?該委員會裡面有很多代表,當然也有社會公正人士,還要互推一位主席出來。
江主任秘書宏哲:是。
陳委員宜民:學術倫理委員會是一個地位中立,很重要的機構,它要對很多與學術倫理相關的糾紛或案件進行審核,國衛院有公布這個名單嗎?還是一樣同屬機密文件?
江主任秘書宏哲:我個人不是很清楚,可能要回去了解一下再向委員報告。
陳委員宜民:大家關心的是中研院學術倫理委員會現在針對這些案件是否應該持一個中立的立場來進行審查。
現在我們來談浩鼎的解盲及C肝新藥,大家都很清楚這些部分是有一定的規範,但解盲之後張念慈董事長又說這是失敗中的成功,所以希望將來能跟衛福部TFDA申請三期的臨床試驗,但若二期臨床試驗或是二加三期臨床試驗已經失敗,可以再來申請三期的臨床試驗嗎?
主席(蔣委員萬安代):請衛福部許次長答復。
許次長銘能:主席、各位委員。FDA還沒有收到他們最後……
陳委員宜民:我是指一般的情況。
許次長銘能:一般來說,若要申請三期,有人會問是不是拿二期加三期的資料以佐證是可以申請三期的,其實這還是要看二期的資料,若可以的話,我們就可以讓其進行三期,當然三期還有所謂實驗設計相關的計畫書(protocol),計畫書內容……
陳委員宜民:所以二期失敗,還是可以繼續進行三期?
許次長銘能:所謂的失敗是他們說的,而解盲是關於效果的部分……
陳委員宜民:經濟學人在最近一期的文章中談到了這個問題,文章主題是「For my next trick(為我的下一個巧計)」,裡面談到現在很多藥廠在做臨床試驗的時候,很多最後的指標常常都不遵守臨床試驗原來的設計,反而從最後的報告中找出一些可能有效的指標,然後去申請藥證,而相關機關有時也不好好審查,就讓它通過,像美國FDA最近就罰了GSK(葛蘭素藥廠)30億美金,因為他們有一種藥叫做PAXIL,主要是治療青少年憂鬱症的一種抗憂鬱症的藥,結果發現這個藥根本沒效,所以被罰了30億美金,等於超過台幣900億。再來,昨天健保署有澄清並沒有這個報紙說的這個數字,但報紙又提到10年要花800億來治療C肝的病人,而上述的藥廠,光是罰金就要900億,因為他們並沒有遵守之前臨床試驗,掩蓋了很多數據,然後直接去申請藥證,所以針對上述的狀況,他們最近有組成了一個所謂的COMPare,針對NEJM、JMMA、BMJ、Lancet、AIM等五大期刊來做evaluation,但才3個月就發現67件臨床試驗的最後報告是根據之前study design做的只有8件,表示86%的報告跟當初臨床試驗的設計是不符合的,所以TFDA有沒有類似COMPare的機制,有系統的去分析臨床試驗,包括浩鼎或是其他新藥公司在向你們申請藥證時,你們會清楚的審查相關資料嗎?換言之,你們並不會被蒙蔽。
許次長銘能:我們對臨床試驗是以很嚴謹的態度來處理,基本上,是核准後才可以做臨床試驗,其最後結果送到衛福部之後,我們會就其提供的書面報告進行審查,然後還會實際去各臨床試驗中心去了解其蒐集資料的過程,甚至個案的相關資訊……
陳委員宜民:有訂定罰則嗎?
許次長銘能:我們是以過程中結論的部分要不要予以准駁來做處理,至於有無罰則一事,就要回到醫療法來做相關的處理。
陳委員宜民:關於C肝,國內感染人口可能高達75萬人,昨日蘋果日報提到了C肝新藥,而昨日本席和劉建國委員參加了一場由4家公關公司舉辦的座談會,無論如何,我們要看緊民眾的荷包,也希望為窮苦無依、買不起這種藥的民眾來說說話,看起來C肝新藥如此昂貴,超過200多萬治療的protocol,但也有一些具愛心的醫師,願意開立處方箋,讓病人可以專案申請學名藥進來,也就是申請從印度、孟加拉進口學名藥,像這樣醫師的處方箋,你們能予以保密嗎?
許次長銘能:目前是有的。
陳委員宜民:但有些醫師表示,他們有受到藥廠sales的騷擾、威脅,讓他們覺得很困擾。這就像以前有些醫師不願為愛滋病患者看病,所以就有一個諮商團體推薦一些願意看診的醫師,一樣的道理,現在若有一些愛心醫師願意開立處方箋,讓病人可以專案申請這種藥進口,那這些處方箋是否應該有一些機制讓它不要流出去,以保護醫師及病人的隱私,不要再受到廠商sales的騷擾?
許次長銘能:對於民眾申請的相關文件,政府本來就有職責要保密,所以應該不是FDA去大肆宣傳哪位醫師願意開立處方箋,總之,在業務相關的範圍內,我們會善盡保密的責任。
陳委員宜民:可否請姜署長確定一下,讓這些醫師願意繼續幫病人開立處方箋?
主席:請衛福部食藥署姜署長答復。
姜署長郁美:主席、各位委員。謝謝委員的提醒,公務人員公務作業形成的所有文件,是有保密規定可以依循,而委員的提醒,我們回去後會特別注意。
陳委員宜民:另外,我們也很關心NRPB的計畫,也就是生技製藥的計畫,之前一開始是由翁院長擔任計畫總主持人,是不是?
主席:請科技部錢次長答復。
錢次長宗良:主席、各位委員。他是諮詢委員會的召集人,計畫主持人是楊泮池校長,後來則改成陳建仁,中間則是賴明詔校長也有接手一段時間。
陳委員宜民:最後是誰關門的?
錢次長宗良:陳建仁因為要參選副總統,所以辭掉主持人一職,後來就交回給楊泮池校長。
陳委員宜民:這個6年計畫花了將近100多億,最近已經結束了,是不是?
錢次長宗良:今年會結束。
陳委員宜民:會不會有第2期計畫?
錢次長宗良:不會有國家型計畫了,但後續的規劃會延續NRPB該做的事情。
陳委員宜民:那經費的額度有多少?
錢次長宗良:我們是採分散處理,整個科發基金……
陳委員宜民:建立一個制度很困難,但摧毀一個制度卻很容易,這麼漫長的時間建立了NRPB計畫,國內各大學、各研究機構也成立了很多研究團體來執行這方面的計畫,表示大家對此有很高的期待,可是你們現在一下子就將它關掉,然後也不再有這方面的計畫,而是挑選那些已經成熟的技術,然後繼續往下推,但對於新藥的開發,你們就不予支持。
錢次長宗良:不是的,我們明年開始的規劃……
陳委員宜民:你們把錢轉到哪裡了?
錢次長宗良:該回到科技部的就回到科技部,科技部繼續支持基礎及轉譯的研究,這些預算都特別匡列在那裡。
陳委員宜民:為何將它disintegrate掉?這個過程很透明嗎?
錢次長宗良:是。
陳委員宜民:真的是大家的共識嗎?
錢次長宗良:我們會有一個專業的諮議委員會來進行監督。
陳委員宜民:相關資料請提供給本席參考。
錢次長宗良:好。
陳委員宜民:我還是要強調,做決策的人擔負著全民的期待,常常有些狀況背後的利益糾葛的部分卻是讓人很失望,希望科技部能有一定的高度,對於這麼重大的計畫,不要輕易的就讓它關掉,其實很多研發團隊,他們已經有momentum在推動、申請了,但你們卻將它關掉,造成大家都很失望。
錢次長宗良:不會關掉,我們會持續推動。
陳委員宜民:好的。謝謝。
主席(陳委員宜民代):請蔣委員萬安質詢。
蔣委員萬安:主席、各位列席官員、各位同仁。很感謝召委今天安排這個議程,即針對我國新藥與疫苗研究開發、上市流程及相關法規之妥適性進行通盤檢討,不過,國人真正關心的是浩鼎案,的確,翁啟惠院長學術地位非常崇高,其專業也深受國人肯定,而浩鼎案中是否有違法失職,也不是我們在此可以置喙的,因為這需要經過司法單位的調查,但藉由此案我們可以回過頭來檢視相關制度面是否有一些不夠周延的地方,因此,從這次最主要的核心,還有技轉、利益迴避等問題,本席要就教王副院長。
各位都知道中研院的陳垣崇所長,他是一位知名的生醫學者,在2005年時成立了一家公司,而中研院獨家授權技術給他來設立這家公司,而這家公司取得專利之後,不管是中研院或是相關醫療機構需要做試劑試驗時,也必須向這家公司來購買;2007年陳垣崇所長擔任某一項計畫主持人,欲進行一項人體試驗,中研院撥了1,500萬向這家公司購買試劑,當時中研院的倫理委員會就針對這個案子提出了質疑,並提出兩點建議,第一,陳垣崇所長如果要繼續擔任計畫主持人,本人及其家屬必須要釋出這家公司的股份;第二,如果想要繼續保有這家公司的股份,則須辭掉計畫主持人一職,而且不能實際參與計畫的任何角色,很明顯的,他只能選擇擔任計畫主持人,放棄商業利益,或者是保有商業持股,然後放棄計畫主持人一職,最後的結果是陳所長反而尋求中研院以外的研究經費以繼續進行該項計畫,亦即上述兩個選項他都沒有選;2010年的時候,檢調有約談他,也就是因為發生這件事,你們擬訂了相關法規,尤其針對技轉這部分,予以大鬆綁,包括2007年生技新藥產業發展條例,這裡面就有針對研究員、科學家,如果將技術轉移到公司,則可以持有10%的股份,同時他們可以擔任創辦人、董事,甚至科技諮詢委員。另外一個法案鬆綁就是科技基本法,該法2010年通過後,放寬了相關研究員不受教職員任用條例、公務員服務法等規定的束縛,所以這些法案對生技產業的發展是非常有助益的,讓學術研究及產業通路完全打開,可是,即使通路打開,但利益迴避相關的規範還是不夠周延,今天才會發生浩鼎案這樣的事情。
大家都知道,中研院有一項內規,方才副院長在答復委員時也提到了一些規範,包括當事人之二親等以內親屬對於有利益衝突的情事,應該要揭露或自行迴避,而且兩年內不得投資技轉的公司,請教副院長,違反中研院內規的效力是什麼?有無相關的罰則?
主席:請中研院王副院長答復。
王副院長惠鈞:主席、各位委員。關於是否有罰則一事,目前要不然就是由倫理委員會來檢視案子,若真的違反法律,就會移送法辦。
蔣委員萬安:中研院科學技術研究發展成果歸屬及運用辦法第三條第二項提到,中研院應設研究成果管理委員會(研管會),請問研管會現在還在運作嗎?
王副院長惠鈞:當然有。
蔣委員萬安:該辦法第三條第二項第五款提到下列事項必須經過研管會審議,包括中研院技術移轉及產學合作應揭露利益、揭露方式及利益迴避。研管會對於違反本辦法規定之情事,得進行必要之調查,並於調查完成後,提請有關單位為必要之處置。所以目前中研院研管會有無開始進行主動調查,同時有無送相關單位處置呢?
王副院長惠鈞:現在院裡有些同仁的確有提案,而倫理委員會正在處理,而我們的研管會目前尚未啟動相關機制。
蔣委員萬安:為何還沒有啟動?
王副院長惠鈞:因為現在很多事情都還不清楚,但是從過去的資料,這73個案子都有按照程序去填寫表格,同時也有經過審議並通過,所以目前就程序而言,我們是還沒有發現有違規的事項。
蔣委員萬安:包括中研院裡的內規,即科技移轉利益衝突迴避處理原則,還有方才提到的研管會的設立及審查的事項,如果有所違反,就要進行必要的調查,而且要送相關單位處置,所以聽起來內規當中,關於利益迴避的違反並沒有罰則規定,是不是?
王副院長惠鈞:是沒有寫在裡面,但方才我有提到,如果違反法律,就由法律來處置,畢竟我們也屬於半公務體系,也有一些懲戒的處置可以適用。
蔣委員萬安:如果法律可以處理的話,那何必訂定內規呢?所以內規應該要有罰則,才能夠約束中研院相關研究員。
王副院長惠鈞:我們不是法官,沒有辦法將他們判罪。
蔣委員萬安:當然,但何必訂定內規呢?這樣一來根本沒有任何拘束效力,當然另外還有研管會運用辦法,其實目前也尚未啟動,而且也已經過了一段時間了,副院長方才提到尚未得到相關的資料,沒有辦法開始啟動進行調查或是進行相關的處置,因此,這些規定都只是宣示性的效果,並沒有辦法實際約束相關的研究人員在利益迴避上應該要揭露或是自行迴避,其實臺灣相關利益迴避的規範並沒有很嚴謹,本席認為,我們可以參考美國的一些法案,他們對學術機構,甚至對聯邦國家實驗室相關利益迴避的要求都是很嚴謹的,像1980年的Stevenson-Wydler Technology Innovation Act和Bayh-Dole Act等兩項法案,他們就規範了相關的技術移轉,目的是要鼓勵技轉,讓學術研究跟產業通路能夠打開,而裡面對於利益迴避(conflict interest),有著非常嚴謹的規範,所以可以做為臺灣的借鏡。
藉由這次的事情,從制度面上,包括相關的法規,甚至中研院的內規,都應該要有更嚴謹的利益迴避規定,而非讓它只具宣示性效果,一旦違反了,也沒有任何罰則、沒有任何懲處,而是認為法律有規範了,不管是公務人員利益迴避或是相關內線交易,當然現行法律就可以規定,若有現行法律,那何必訂定內規呢?所以只有宣示性效果的話,那是不夠的。
王副院長惠鈞:方才提到的處置,委員也可以提供意見,看看何者才是最好的處置,但就我個人的看法,連院長的職位都丟了,還有比這個更嚴重的處置嗎?
蔣委員萬安:目前他只有請辭而已,但今天若是別人有同樣的情況,我還是希望能夠回到制度面,就照著規定走,而且藉由這個事情,中研院能檢討內部相關規定。
王副院長惠鈞:我同意。
蔣委員萬安:我們鼓勵生技產業的發展,也希望技轉能夠持續進行,但是對於利益迴避相關規範,其實應做一個通盤檢討,不管是內規或是研管會的啟動,應該更為積極。
王副院長惠鈞:這個我們會來檢討。
蔣委員萬安:未來新政府上台後,生技產業仍是五大產業中非常重要的一環,而我也希望繼續鼓勵相關的技轉,讓優秀的科學家能夠繼續在研發上提供貢獻。同時也不希望此一單一個案,影響到生技產業的發展。總之,希望藉由這次事件能夠來做通盤的檢討,同時也希望翁院長能儘早回國,對整個事件的始末做一清楚的說明,這個意見希望副院長能夠加以轉達,好不好?
王副院長惠鈞:好。謝謝。
主席(王委員育敏):俟黃委員秀芳質詢完畢就處理臨時提案,然後中午休息,下午2時繼續開會。
請陳委員瑩質詢。
陳委員瑩:主席、各位列席官員、各位同仁。本席今天並沒有要質詢很多問題,但這些問題已經累積很多年了。首先,關於預防接種受害救濟審議案件的統計數字來看,從民國91年至104年分別是,91年20件;92年17件;93年18件;94年19件;95年38件;96年24件;97年55件;98年57件;99年606件;100年128件;101年106件;102年98件;103年86件;104年74件,大家可以很清楚知道,從91年至104年,超過100件的次數並不多,但99年忽然飆高到606件,這是什麼原因呢?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。我沒有記錯的話,可能是99年因為H1N1疫苗施打量較多所引起,這部分我還要再確認當時的情形,包括申請案件的內容。
陳委員瑩:次長說得沒有錯,99年那年發生了一件大事,就是有H1N1的疫情爆發,也是國光疫苗剛剛問世的時候,雖然當時各界對疫苗的製程都有很多的疑慮,但後續一直到今年,大家都還是有針對流感去施打國光疫苗,而且有不良反應的件數也大量減少了,但大家還是覺得很奇怪,為何99年的件數就是特別高?這些年國光疫苗的製程、標準、規範有沒有改變或是調整呢?醫療級雞胚胎蛋的來源有無做一些調整或是改變?
許次長銘能:國光疫苗製造的過程中,我們幾乎每年都會去查察,看其品質有無符合製造的規範。此外,自104年1月,所有藥品的製造工廠都要符合國際最嚴謹的標準,就是PIC/S GMP的標準,而國光也是要符合PIC/S的標準,所以整個藥廠製造的過程都依照更新的法規來予以要求。
陳委員瑩:表示國光後來的製程跟當初99年是不一樣的?
許次長銘能:這可能還是要看其製程的部分,剛開始他們是用雞胚胎。
陳委員瑩:到現在還是嗎?
許次長銘能:到現在還是用雞胚胎。
陳委員瑩:民國99年國光疫苗不良反應案件有606件,直到現在不良反應案件則在100件以下,有誰可以告訴我,為何兩項數據會有相當大的落差?事實上,前、後幾年的案件數差距大多在500件以上,你們如何解釋?國光疫苗不良反應案件數有下降的趨勢,當然,我們樂見它有進步,但問題在於,民國99年國光疫苗不良反應案件數量究竟為何飆高?因此,本席才會質疑到底國光疫苗製程上有做過什麼樣的改變?畢竟尚有許多受害者家屬正在打官司。
許次長銘能:是的。針對此一問題,能否請當時在審查CDE的詹組長就技術上向委員做詳細報告?
陳委員瑩:好的。
主席:請衛福部醫藥品查驗中心新藥科技組詹組長答復。
詹組長明曉:主席、各位委員。2009年H1N1疫苗不良反應通報率特別高,其原因有二:第一,當年因為全國國家進行疫苗接種(National campaign),所以施打人數的基礎值較高。第二,平常我們都是採取被動通報,當年我們採取被動通報與主動通報兩種監測系統,所以這一定會拉高通報率,但僅有那一年……
陳委員瑩:換言之,僅民國99年才有拉高通報率,之後幾年則都沒有嗎?
詹組長明曉:對於常規接種的疫苗,通常我們都不做主動監測。
陳委員瑩:其中所具有的潛在問題在於,之後沒有主動與被動通報系統,你們可能會遺漏一些疫苗接種的不良反應事件,以致後續數字有所疑慮。
詹組長明曉:就是在被動監測之下……
陳委員瑩:對,如果接續都採用被動通報及主動通報,這個數據也一樣會飆高。
詹組長明曉:對,這是一定的。因為這是經由監測系統而得的數據,如果愈積極去問,就會接獲愈多的通報。
陳委員瑩:就數據而論,民國99年案件數量升高,主要因為通報問題才會產生數據上的差別,而不是國光疫苗不良反應案件大增。你可以保證這項數據與國光疫苗製程完全無關,只是通報的方式不同所致嗎?
詹組長明曉:對,委員釐清兩項重點:第一,全國民眾大量施打疫苗;第二,因為有積極通報,上述兩項因素都會拉高通報率,至於是否有疫苗安全性的問題,則必須蒐集大量的資料。事實上,當年國人所施打的兩家流感疫苗數量,諾華施打50萬劑,國光約施打500萬劑,之後疾管署針對相關資料有做完整的安全性分析的相關文章,相關文章也刊登在國際的知名期刊分析其安全性,事後證明,無論施打國際大廠諾華或施打國產的國光疫苗,在國內所關注的各個重要風險上並無差異。其實,這些資訊必須仰賴大量的資料分析,包括國家有很好的健保資料庫所做的安全性與專業性分析,事實上,疾管署在事後有做非常詳盡的……
陳委員瑩:依照你的邏輯來看,第一,民國99年國人大量施打疫苗;民國100年之後,國人就沒有大量施打。第二,民國100年之後,因為你們沒有啟動主動通報系統詢問,以致遺漏不良反應的通報案件數。
詹組長明曉:應該說這是自然低估所致,這點並沒有錯,那你對於……
陳委員瑩:但本席要強調的問題是,兩者數據為何會相差500件?
詹組長明曉:我想這個在監測上確實會造成這樣的落差。
陳委員瑩:如果國光疫苗沒有問題,那麼後續的通報與全面施打就是我們應該檢討的問題。是嗎?
詹組長明曉:因為我們並不可能使用全部的資源做這麼多的事情,但有時候……
陳委員瑩:今年流感疫情非常的嚴重,我們應否比照民國99年,向國人大量施打疫苗,並擴大主動通報。
詹組長明曉:此一問題必須由疾管署與衛福部進行通盤檢討,考量有無再啟動相關機制的需要。
陳委員瑩:你認為這是有必要的?
詹組長明曉:我認為將視產品屬性而定。事實上,流感疫苗問市已有50年,這是大家很熟悉的產品,我們是不是要花這麼多的資源……
陳委員瑩:國光疫苗問市才五、六年,不是嗎?
詹組長明曉:國光疫苗經過嚴謹的技轉基礎之下在臺灣上市,事實上,其前身是日本北里完全製程的轉移……
陳委員瑩:本席今日質詢並沒有特定的立場,認定國光疫苗是好或不好,只是當年我在衛環委員會擔任召委關心國光疫苗案件,特別像劉醫師的小孩施打新流感疫苗過世,大家也對於B19病毒有許多的討論。雖然B19病毒是存在人體,而非存在雞蛋裡,但有誰可以保證在國光疫苗製程中,並非人為因素導致施打某批次的國光疫苗而感染B19病毒?我們對此仍有諸多的疑點,所以今天我特別提出相關的問題。此外,方才我詢問流感通報系統及大量施打疫苗等問題,就我們方才討論的結果,衛福部應該針對這兩部分進行檢討。
最後,我要詢問有關疫苗雞胚胎蛋的問題,因為疫苗製造公司一時間需要進用大量醫療級雞蛋,許多人對於來源雞蛋多有疑慮。根據國光的報單顯示,雞蛋的來源國有臺灣、美國及荷蘭,請教部長,衛福部通常是照單全收,還是你們有做勾稽及落實查核的工作?
許次長銘能:有的。在以往的食品藥物管理局與CDE的部分,除了廠商所送來的資料以外,我們還要查詢其所提供相關單位的部分。
陳委員瑩:換言之,你們有前往蛋廠去查嗎?
許次長銘能:對,我們有到蛋廠直接去查。
陳委員瑩:在排除相關因素之後,無法驗證是否因為疫苗製程中遭受B19病毒的污染,對不對?
許次長銘能:對,我們一直在蒐集這部分的相關資料。
陳委員瑩:本席請衛福部提供下列資料:一、當年國光製造流感疫苗時申報醫療級雞蛋來源證明及核可文件。二、請國光公司公開引起嚴重不良反應事件的疫苗批次、雞蛋來源及疫苗製程的品管紀錄文件。可以嗎?
許次長銘能:國光公司實屬民營機構,政府是否有權力依法要求該公司公開相關資料?
陳委員瑩:你們不是有他們的申報文件?
許次長銘能:我們只能針對他們不涉商業機密的部分,可以提供……
陳委員瑩:這些商業機密正是涉及人命關天的問題。
許次長銘能:我們會依照相關審查……
陳委員瑩:請衛福部設法解決。好嗎?
許次長銘能:好的。
陳委員瑩:謝謝。
主席:請黃委員秀芳質詢。
黃委員秀芳:主席、各位列席官員、各位同仁。日前日本已有多名女性接種子宮頸癌疫苗引發副作用,請教次長,目前臺灣女性使用子宮頸癌疫苗是哪兩家公司製造的,這與日本引發副作用的子宮頸癌疫苗是否相同?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。目前國人使用的是美國默沙東(Merck)藥廠及荷蘭葛蘭素史克(GSK)藥廠生產的疫苗。
黃委員秀芳:這與日本民眾所使用的疫苗是否一模一樣?
許次長銘能:是的。
黃委員秀芳:現今國內女性施打子宮頸癌疫苗引發副作用有幾件通報個案?
許次長銘能:經過多年的累計結果,國人施打子宮頸癌疫苗有不良反應通報件數總共146件。
黃委員秀芳:國人施打子宮頸癌疫苗有出現類似日本女性的副作用嗎?
許次長銘能:目前沒有發生像日本那麼嚴重的不良反應案件,一般屬於暈針或施打部位疼痛等通報。
黃委員秀芳:請教次長,現今中央政府推動施打子宮頸癌疫苗的公費推廣措施,而且各縣市政府也編列預算補助民眾施打疫苗,衛福部針對國人施打子宮頸癌疫苗引發副作用有無建立通報機制?
許次長銘能:一般而言,國人施打疫苗引發副作用通報的部分,臨床醫師在施打過程中,如果發現異常情況就會將個案通報至藥害基金會,該基金會設有窗口接受申請。至於地方政府由臨床醫師施打疫苗也會個案通報;至於政府推動公費子宮頸癌疫苗,也會有相關的通報資訊。
黃委員秀芳:本席接獲消息,各縣市衛生局公費補助國人施打的子宮頸癌疫苗,衛福部完全未建立通報機制。萬一國人出現類似日本女性產生副作用的個案,衛福部到底如何協助?針對各縣市政府補助國人施打子宮頸癌疫苗,衛福部應否建立完整的通報制度?
許次長銘能:對於委員所垂詢的問題,本人說明如下:第一,在各縣市政府公費補助國人施打子宮頸癌疫苗部分,在施打疫苗過程中,我們會請臨床醫師注意國人是否有類似日本女性施打後引發副作用的情形,倘若發現類似情況,應立即通報政府相關部門。第二,民間診所醫師或私人醫院提供民眾自費施打子宮頸癌疫苗的部分,我們會責成各衛生局通知醫療院所,當婦產科或小兒科醫師發現民眾接種疫苗引發嚴重的不良反應時,請他們立即通報,我們也會密切注意。
黃委員秀芳:近幾年,國人接種子宮頸癌疫苗的成效到底如何?如果國人接種疫苗的成效良好,除了衛福部補助各縣市中的低收入戶及偏遠地區女性公費施打子宮頸癌疫苗之外,目前有幾個縣市也有補助女性施打疫苗?
許次長銘能:地方政府補助女性接種子宮頸癌疫苗,最早開始的是金門與馬祖,後來才是新北市……
黃委員秀芳:目前有幾個縣市有提供民眾補助接種?
許次長銘能:我不太清楚詳細的情況。據我所知,目前有新北、嘉義、桃園等縣市……
黃委員秀芳:國人接種子宮頸癌疫苗的成效到底如何?
許次長銘能:有關疫苗成效的部分,從查驗登記相關資料,民眾施打疫苗之後會在人體產生抗體,這些抗體對於子宮頸癌具有特殊的基因型,疫苗在人體中產生抗體就會具產生保護力。
黃委員秀芳:次長認為施打效果很好?
許次長銘能:委員垂詢施打成果的問題,當然要從臨床醫師所獲得的數據,以證明施打疫苗是有效的。
黃委員秀芳:現今衛福部及各縣市政府都有補助國人接種公費子宮頸癌疫苗,國民健康署能否研擬施打對象擴及全國各縣市的女性?據我所知,現今女性民眾接種子宮頸癌疫苗價格滿昂貴的,如果其他縣市政府也以公費購買子宮頸癌疫苗,也許就能壓低疫苗價格造福更多的人?
許次長銘能:就國民健康署的癌症防治立場而言,在經費有限的情況之下,先提供弱勢族群免費接種子宮頸癌疫苗,至於政府開放全國女性免費接種子宮頸癌疫苗,必須進行財務分析,才能考量是否足以負擔相關經費,這也是我們必須要做相關的評估。
黃委員秀芳:請衛福部研擬相關方案。
許次長銘能:好的。
黃委員秀芳:另外,現今全球藥品市場的規模非常大,臺灣製藥廠在全球藥品市場中大約占多少百分比?
許次長銘能:臺灣製藥廠在全球藥品市場占不到1%。
黃委員秀芳:依照次長的分析,為何會發生這種情況?
許次長銘能:現今臺灣製藥廠除了研發新藥之外,最主要是研發學名藥,但臺灣研發學名藥必須與世界各國的學名藥相互競爭,基於競爭的立場,這部分尚有很大的空間需要再突破。當然,研發新藥不但風險高,而且投注的資本也高,在此情況之下,所生產新藥的案例較少,所以我們也與經濟部……
黃委員秀芳:好的。請問經濟部針對研發新藥有無提出配套措施,以鼓勵投資者投入研發新藥的生技產業?
主席:請經濟部工業局呂副局長答復。
呂副局長正華:主席、各位委員。現今許多產業適用產創條例,但是,在生技方面具有特定產業的鼓勵措施,根據生技新藥發展條例規定,包括人才、投資5年免稅及租稅抵減,都比一般產業較具鼓勵措施,所以本局技術處都會執行相關計畫。
黃委員秀芳:請教許次長,雖然經濟部規劃鼓勵生技研究新藥的措施,有些投資者認為研發新藥期程過久,自己投資不一定會獲得良好效益,進而降低他們的投資意願,但最主要的原因是,臺灣最大的藥品市場是在全民健保的部分,然而全民健保對藥品給付金額很低,確實是「殺很大」,有些藥品原本定價100元,殺價後只剩下三、四十元。為了鼓勵在臺灣研究製造的藥廠,衛福部健保署應否提高全民健保給付金額?
許次長銘能:全民健保有針對藥品制定相關條文,主要鼓勵國產藥品優惠核價的機制,事實上,本部針對在臺灣投資、研發、生產的國產藥品部分也有對外公布,都相對比照……
黃委員秀芳:國產藥品是比照什麼價格?
許次長銘能:第一個部分我們是比照市場的價格,第二個部分,它可以用成本價格做相關的核估,事實上,這些部分都有一定的遊戲規則與計算公式……
黃委員秀芳:最令人詬病的是,現今全民健保實施總額制度與藥價給付,讓一些生技產業卻步,我們希望健康保險署針對在臺灣研發、生產的新藥,能夠給予合理的給付,如此才能夠讓生技產業留在臺灣製藥。事實上,我們看到新藥一年的產值不到1,000萬美金,整體產值還滿低的。針對本席所提出上述的問題,請衛福部詳細研究,既然政府要鼓勵新藥生技產業,請你們在這方面再多加琢磨。以上,謝謝。
許次長銘能:是的,謝謝委員的指教,我們會再努力。
主席:接下來處理臨時提案,共計6案。
進行第1案。
1、
查近日因食物浪費及耗損所產生的資源浪費議題,伴隨全球暖化加劇而日漸受到重視,我國目前針對食物浪費(耗損)缺乏積極的管理與輔導措施,環保署廢管處雖有管理食物經由「廢棄」後所產生的「廚餘」,衛福部則經食品的有效日期確保食品安全以及即期品管理,但據媒體保守估計,臺灣平均每人每年生產約96公斤的廚餘,四大超商每日報廢的鮮食平均高達二成,數量約可養5,000頭豬,足見國內食物浪費(耗損)問題不容小覷。爰此,建請衛福部於一週內盤點國內量販店與超商通路在各類型即期品、過期食品(包含包裝食品、蔬果、水產及鮮食等不同類型)的數量統計,並依其食物品質特性及儲存方式之差異,研擬多元管道促進即期與過期食品獲得更妥善運用。
提案人:陳曼麗
連署人:黃秀芳 林靜儀
主席:請問各位,對本案有無異議?
請衛福部食藥署姜署長說明。
姜署長郁美:主席、各位委員。倒數第四行的「建請衛福部於一週內」,是不是可以改為「一個月」?我們剛剛討論過了。另外,除了過期品,還有很多損耗的部分,我們建議將「過期品」的部分都改成「報廢食品」。
主席:針對第1案,照署長的意見將倒數第四行「一週內」改為「一個月內」,並將「過期品」三字均修正為「報廢食品」外,其餘文字均照原提案內容通過,請問各位,有無異議?(無)無異議,修正通過。
進行第2案。
2、
有鑑於中研院研究人員現已針對浩鼎案進行連署,籲求違反「中央研究院研究人員及研究技術人員倫理規約」之行為,由倫理委員會進行審議,爰建請中央研究院於兩周內提供近十年倫理委員會審議結果,以昭學術自律決心。
提案人:王育敏
連署人:蔣萬安 李彥秀
主席:請問各位,對本案有無異議?
請中研院王副院長說明。
王副院長惠鈞:主席、各位委員。這個案子跟下一個案子都跟中研院有關,我先解釋第一案,第一句的「有鑑於中研院研究人員」可不可以改為「有鑑於中研院有些研究人員」?這樣寫,好像是我們全部的人。第二句「籲求違反……之行為」,還沒有調查就說已經違反,是不是改為「籲求若有違反……之行為,由倫理委員會進行審議」?下面的「爰建請中央研究院於兩周」也一樣,是不是給我們「一個月」的時間來處理?因為接下來提到「近十年倫理委員會審議」,倫理委員會審議的所有事情不只是技術轉移案件,是不是可以侷限在「科技技術移轉之相關案件」?
主席:可以。
王副院長惠鈞:因為裡面有很多其他的案件,對於當事人有保密的問題等等。
主席:好,沒問題。
王副院長惠鈞:我舉個例子,包括性侵害這一類的案件,好不好?
主席:好,就是在科技技術移轉部分。
王副院長惠鈞:剛才這樣的修正可以嗎?要不要唸一遍?
主席:你再唸一遍,好不好?
王副院長惠鈞:「有鑑於中研院有些研究人員現已針對浩鼎案進行連署,籲求若有違反『中央研究院研究人員及研究技術人員倫理規約』之行為,」我不知道為什麼這裡要匡起來,是不是要比較具體,改為「違反倫理委員會的……規範」會比較好一點?接下來是「由倫理委員會進行審議,爰建請中央研究院於一個月內提供關於科技技術移轉之案件審議結果,以昭學術自律決心。」,大概是這樣。
主席:你再把精確的修正文字給議事人員,好不好?
王副院長惠鈞:好,我會再給你們。
主席:針對第2案,照王副院長所提文字修正意見通過,請問各位,有無異議?(無)無異議,修正通過。
進行第3案。
3、
有鑑於現行中央研究院科技移轉利益衝突迴避處理原則,第三條規定當事人含括「當事人之二親等以內親屬」,惟「中央研究院科技移轉利益揭露表填表說明」中說明二親等以內親屬範圍未列入「子女」,然查現行公職人員利益衝突迴避法及國衛院相關技轉利衝迴避規定等,並無任何排除規定,爰建請中央研究院應於一周月內清楚說明該規定之訂定意旨並研議修正,以昭學術公信。
提案人:王育敏
連署人:蔣萬安 李彥秀
主席:請問各位,對本案有無異議?請中研院王副院長說明。
王副院長惠鈞:主席、各位委員。我們做這樣的建議,字句中的「卻排除『子女』」可不可以改成「卻未列入『子女』」?後面的「一周內」,牽涉到要「研議修正」,須由研管會來修改辦法,是不是也給我們「一個月」的時間?因為還要召開研管會,研管會牽涉到的人還滿多的,不曉得大家是不是都有時間。
主席:改成「兩周」可不可以?因為這都有其他可參照的啊!國衛院就已經有了。
王副院長惠鈞:因為要「研議修正」,我們要開研管會,才有權力做這個修正。我們會儘快!是不是就暫列「一個月」?如果我們修好了就給你們。
主席:請儘快,如果你們進度超前的話,就趕快送到委員會來,好不好?
王副院長惠鈞:是,這樣可以嗎?
主席:好,可以。
王副院長惠鈞:謝謝委員。
主席:進行第4案。
4、
有鑑於浩鼎案持續延燒,顯示我國現行針對新藥解盲結果有不同解讀,迭生爭議。爰建請金管會會同衛生福利部一個月內共同研議解盲重大訊息揭露原則,以確保投資大眾之權益。
提案人:王育敏
連署人:蔣萬安 李彥秀
主席:請問各位,對本案有無異議?
請金管會證期局張副局長說明。
張副局長麗真:主席、各位委員。新藥公司怎麼去進行解盲及公布結果是非常專業的,而且要有一致的處理原則,需要衛福部在專業的源頭部分加以規範。資訊公開是在後端,金管會也願意配合。我們建議,是不是改成「爰建請衛福部一個月內研議公布解盲結果之一致處理程序,並會同金管會研訂資訊公開相關規範,以維護投資大眾之權益。」?
主席:請衛福部食藥署姜署長說明。
姜署長郁美:主席、各位委員。衛福部不同意改,因為所有重大訊息揭露的部分並不是衛福部去訂定的,是金管會訂定的,對於「重大訊息揭露原則」是不是包含解盲或其他的訊息,由金管會會同衛福部共同來討論。
主席:金管會可以吧?
張副局長麗真:誠如委員早上所質詢的,而且衛福部好像也回應了,同意是由衛福部這邊來會同金管會。因為要不要解盲、怎麼去公布,確實牽涉到很多專業性的部分,就金管會的立場來說,我們可能沒有辦法去規範其內容,但對於資訊公開的方式,金管會絕對可以配合做處理。
主席:請衛福部許次長說明。
許次長銘能:主席、各位委員。這裡的最後一段話是寫「確保投資大眾之權益。」所謂「投資大眾」之權益確保的主責單位應該是金管會,如果由衛福部去訂定一個揭露原則,以確保投資大眾之權益,我覺得有一點奇怪,還是要認定清楚權責機關,主責機關金管會對於重大資訊揭露的部分一定有一個什麼樣的原則。至於宣布解盲的這件事情,我們沒辦法去考慮為確保投資大眾之權益而制定所謂解盲的程序,還是要回歸到整個投資部分的相關規定。未來若是金管會要確保投資大眾之權益,對於重大資訊揭露原則,涉及到解盲的資訊部分,在揭露過程中有沒有影響到投資大眾之權益的這一塊,我們可以提供專業的諮詢。
主席:針對本案,就按照本席提案的內容,不要再修改了。第4案照案通過。
進行第5案。
5、
依據遠見雜誌2016年4月號出版「健保卡住新藥發展,要150元僅給69元」乙文,國內健保制度未能連結產業發展政策,不根據健保法藥品給付項目與支付標準規定,對國內自製新藥有優惠核價,此舉將導致國內生技產業研發新藥的動力受挫,再者,亦將嚴重影響國內生技產業的新藥外銷價格,因為歐、美、日等國核定給付價亦會參考我國對該新藥健保核價(健保署均會上網公告)。爰此,要求衛福部於一個月內,向立法院社會福利及衛生環境委員會提出檢討報告。
提案人:劉建國 黃秀芳
連署人:吳玉琴 鍾孔炤
主席:請問各位,對本案有無異議?(無)無異議,照案通過。
進行第6案。
6、
新藥查驗登記或上市後之管理,很多法規都需要額外的公告再去解釋或加強,相關法規與時俱進,主管機關應加強法規宣導,以利廠商遵循。爰此,要求衛福部於一個月內,向立法院社會福利及衛生環境委員會提出檢討報告。
提案人:劉建國 黃秀芳
連署人:吳玉琴 鍾孔炤
主席:請問各位,對本案有無異議?
請衛福部食藥署姜署長說明。
姜署長郁美:主席、各位委員。對於內容我們沒有意見,願意配合,但在「要求衛福部於一個月內」的部分可不可以改成「兩個月」?
主席:黃委員有沒有意見?可以嘛!
姜署長郁美:謝謝。
主席:那就改成「兩個月」。
臨時提案已經處理完畢,現在休息。下午2時繼續開會,謝謝。
休息
繼續開會
主席:現在繼續開會。請楊委員曜質詢。
楊委員曜:主席、各位列席官員、各位同仁。臺灣經常有腸病毒疫情肆虐,而我們大概是從07年開始研發腸病毒疫苗,請問江主秘,臺灣到底什麼時候可以看到腸病毒疫苗正式上市?
主席:請國家衛生研究院江主任秘書答復。
江主任秘書宏哲:主席、各位委員。有關國衛院的腸病毒疫苗研發,到臨床前期階段時就已經技轉給國內生技廠商繼續往商業化方式去走,現在大概是在臨床第二期。
楊委員曜:所以什麼時候上市不知道?上次預算審查時,我曾詢問過有關技轉權利金的問題,請問這個腸病毒疫苗研發的技轉權利金是多少?你不知道?
江主任秘書宏哲:抱歉,這個……
楊委員曜:沒有關係,因為我一直在想我們的技轉權利金會不會太低,所以預算審查時有提出詢問。
江主任秘書宏哲:是,委員有關心過,因為國衛院是拿政府的補助,我們也儘量以協助國內廠商發展為主,所以我們所收取的權利金都不會高。
楊委員曜:你們的技轉對象是由國衛院決定的嗎?
江主任秘書宏哲:如果是專屬技轉,我們會報衛福部同意……
楊委員曜:什麼叫做專屬技轉?
江主任秘書宏哲:就是在國內只有技轉一家廠商。
楊委員曜:報衛福部同意就可以了?
江主任秘書宏哲:對。
楊委員曜:這樣就可以了?
江主任秘書宏哲:要經主管機關同意,我們自己都不能同意,必須是主管機關同意。
楊委員曜:如果有其他廠商也想要研發呢?有沒有這種情形?
江主任秘書宏哲:有。
楊委員曜:如果發生這種情形,你們怎麼處理?
江主任秘書宏哲:流感疫苗就是將技術同時轉給國內的兩家廠商。
楊委員曜:對於同一個研發成果,如果有多家廠商提出申請,你們就會技轉給多家廠商嗎?
江主任秘書宏哲:不是,如果這個技術是非專屬授權,就可以技轉給多家廠商,大家各自去努力……
楊委員曜:如果是專屬的呢?
江主任秘書宏哲:就只給一家廠商。
楊委員曜:這一家廠商是怎麼選定的?
江主任秘書宏哲:還是……
楊委員曜:因為技轉權利金低,怎麼審定就很重要了。
江主任秘書宏哲:有關這個問題,我請本院技轉室葉主任來答復。
主席:請衛福部國家衛生研究院技轉室葉主任答復。
葉主任忠祐:主席、各位委員。有關於專屬授權,國衛院內規有相關規定,對於專屬授權,廠商要先提出企畫書,我們進行初步行政審查,如果行政審查沒有問題,不管是一家或多家要進行專屬授權,我們就要去比誰有能力可以承接,讓這個技術最快商業化,評比條件不單只有技轉金,更何況國衛院是受政府捐補助……
楊委員曜:技轉金是不是其中一個評比條件?
葉主任忠祐:當然會是其中一個考量點,但不會是唯一的考量點,因為我們還是要評估整個團隊的能力,看看這家廠商是不是最適合的,畢竟專屬授權只能給一家,我們當然希望能找到最合適的廠商。
楊委員曜:主秘,我聽說中國大陸已經完成腸病毒疫苗的試驗,而且也已經上市了,是不是這樣?
江主任秘書宏哲:是,有看過這個報導。
楊委員曜:為什麼國衛院的研發速度會比較慢?
江主任秘書宏哲:有關這個問題,我請疫苗所廖所長來答復。
主席:請衛福部國家衛生研究院感疫所廖所長答復。
廖所長經倫:主席、各位委員。國衛院已經技轉到二家廠商,他們是照國家食藥署的步驟在進行……
楊委員曜:你們是去年技轉的還是今年技轉的?
廖所長經倫:民國100年就技轉了,他們都在期限中按部就班的來進行。
楊委員曜:民國100年就技轉了,現在到達臨床第幾階段?
廖所長經倫:二期已經……
楊委員曜:總共要幾期?
廖所長經倫:總共三期,完了之後才……
楊委員曜:所以我們程序是比較……
廖所長經倫:比較嚴謹、比較慢一些,這需要時間來保證其品質,尤其是對小孩子的試驗,要徵召這些小孩來做比較嚴謹的試驗。
楊委員曜:對,不論是疫苗或藥物,都需要經過慎重縝密的程序與階段。好,二位請回座。
江主任秘書宏哲:好,謝謝委員。
楊委員曜:請問科技部錢次長今天下午有列席嗎?
主席:楊委員,次長有特別報告下午要請假。
楊委員曜:那下午科技部由誰代表列席?
主席:由科技部前瞻及應用科技司楊副司長代表列席。
楊委員曜:本席發現衛福部與科技部這二個部會對於研究發展成果歸屬與運用的規定在某部分不相同,衛福部的相關研究成果是限於國內製造使用,而科技部則是只要研究發展單位內部行政程序簽准,就能授權給國外製造使用,請問為什麼科技部可以授權國外而衛福部不行呢?又或者是為什麼衛福部只把成果留在國內?副司長聽得懂本席提出這個問題的意思嗎?
主席:請科技部前瞻及應用科技司楊副司長答復。
楊副司長琇雅:主席、各位委員。委員問到的問題滿細的,依照科技部的現行規範,有部分如果使用到科發基金,就要40%要回繳到……
楊委員曜:不是,我不是問權利金的問題,而是授權製造使用的對象,有關國內研究的成果,衛福部是留在國內,而科技部則可以授權到國外,理論上各部會的研究成果,如果可以授權給國外,就應該統一都可以,如果不行就應該全部都不行,為什麼二個部會的規定不同?次長,你們是不是有被監察院提出糾正過?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。其實我們的條文規定是以國內為優先,並不是禁止授權到國外。
楊委員曜:以國內為優先?
許次長銘能:是。
楊委員曜:不過我看條文似乎不是這樣規定耶!
許次長銘能:因為國衛院所做的研究都是以國人健康為主,所以我們比較希望能技轉給國內的廠商,以照顧國人健康為優先考量。
楊委員曜:副司長,技術研發成果移轉給國內或國外,權利金有沒有差別?
楊副司長琇雅:權利金應該沒有差別,但依照我們的規範,我們還是希望優先給國內廠商使用。
楊委員曜:方才國衛院提過,技轉的權利金低是因為他們使用國家資源來做研究,如果將研發成果留在國內使用、讓國人享受,雖然技轉權利金低,但大家可能還能接受,但如果技轉給國外的權利金也沒有差別,這說得過去嗎?
楊副司長琇雅:委員,這個部分容我們之後再向委員做比較詳細的說明。
楊委員曜:我現在先把問題點出來,請你們回去研究一下,如果真的要將研發成果授權給國外,技轉權利金一定要跟技轉給國內有所區別,畢竟所有研究費用都是臺灣花的錢,把研發成果留在國內使用,技轉權利金低一點可能沒問題,但如果技轉給國外也收一樣的權利金就不行了。
楊副司長琇雅:好。
楊委員曜:許次長,澎湖有很多C肝患者,現在印度新型C肝口服藥的效果比目前國內使用的干擾素好一點,對不對?
許次長銘能:有關C肝的部分,目前用干擾素加上其他藥物治療,其治癒成效相對沒有現在新上市的新藥來得好。
楊委員曜:而且我們現在遇到一個困擾,以澎湖來說,干擾素的治療,健保只給付二期,二期後要繼續治療就必須自費,或是應用一期之後醫生就停用,如果能夠讓新型藥變成健保給付藥,對廣大的C肝患者是一大福音。
許次長銘能:目前還在評估這個藥是不是要納入健保給付,因為這會對財務產生相關的衝擊,所以最後還是要提到健保會去……
楊委員曜:很貴嗎?
許次長銘能:目前世界各國對於這個藥品的價格不一樣,但是臺灣因為市場機制關係,這個藥還沒有納入健保給付的部分,有些藥高達200多萬,有些藥100多萬,未來若是納入健保,我們會參考其他國家的價格再與藥廠討論。
楊委員曜:好,請你們儘量去議價,把價格壓低,照顧國人健康最重要。
許次長銘能:我們也是朝這個方向在審核這項藥品的藥價。
楊委員曜:好,謝謝。
許次長銘能:謝謝委員。
主席:請管委員碧玲質詢。
管委員碧玲:主席、各位列席官員、各位同仁。本席此時此刻是用戒慎恐懼的心情要與副院長討論翁啟惠院長所涉及的這個重大案件,我們今天看到翁院長給教育及文化委員會的說明書,但是在說明書中,翁院長並沒有表明他什麼時候要回國,對此我們感到非常遺憾,本席在此鄭重呼籲翁院長要儘速回國來釐清所有事實的真相,還給中研院清淨與清白。
對於這整件事情的討論過程,本席非常關注的是,對於翁啟惠院長所涉及的這個事件及所涉及的範疇應該用什麼樣的思考檢測工具來考量,是要用公務員利益衝突迴避法、貪污治罪條例、科技基本法還是中研院相關的法規命令?另外當然可能還涉及到證券交易法等多項相關法律,但總是要先把事實釐清才知道要如何定位。
我一直在摸索與追查,但到現在還沒辦法釐清足夠的事實真相,所以今天特別在這裡與副院長交換意見。大家最近比較常使用的工具是中央研究院科技移轉利益衝突迴避處理原則,該處理原則第二條規定「本原則所稱科技移轉,指將歸屬於本院之科技研發成果授權或讓與業者做產業利用,包括提供技術服務或材料。」,也就是說,這個利益衝突迴避處理原則要處理的是屬於中研院權限的研究成果技轉案件,如果翁啟惠這次所涉及的案件不屬於中研院相關的技術移轉,請問他受不受這個處理原則的規範?
主席:請中研院王副院長答復。
王副院長惠鈞:主席、各位委員。聽起來好像應該不用。
管委員碧玲:所以他不必揭露,他也沒有違反利益衝突迴避原則,假設他所涉及的這個項目非屬中研院的研究成果,他就不受……
王副院長惠鈞:至少不受中研院的規範,因為那不是中研院的東西。
管委員碧玲:對!那這3,000張股票到底跟中研院有沒有關係?你們釐清了嗎?
王副院長惠鈞:有一些部分是牽涉到翁院長……
管委員碧玲:我製作了一張圖,請大家看看這張圖。這300萬股怎麼來的?有一家公司Optimer有三位創辦人──張念慈、翁啟惠及Danishefsky,其中這位美國教授發明了OBI-822,這個東西與翁啟惠無關,到目前為止……
王副院長惠鈞:發明的部分無關。
管委員碧玲:但因為是共同創辦人,所以他可能有權限、有股票,這個我們先不管,我們先來看浩鼎與Optimer有什麼關係,浩鼎為了買OBI-822,所以作價6,000萬股給Optimer,是不是?
王副院長惠鈞:應該是這樣。
管委員碧玲:所以Optimer擁有浩鼎的股票是因為OBI-822而來,後來浩鼎把股票買回來,浩鼎將這6,000萬股的股票(Optimer所擁有的浩鼎股票)買回來時,就找股東來認購,其中有300萬股是翁啟惠的女兒認購的,是不是?
王副院長惠鈞:是。
管委員碧玲:也就是說,翁啟惠的女兒認購的這300萬股浩鼎股票,是當初Optimer賣OBI-822而來的那6,000萬股中的300萬股,對不對?
王副院長惠鈞:是。
管委員碧玲:所以這300萬股的股票直接相關連的技術是OBI-822,對不對?
王副院長惠鈞:是。
管委員碧玲:OBI-822與中研院有沒有關係?
王副院長惠鈞:發明的部分沒有關係。
管委員碧玲:所以技術移轉就不屬中研院相關技術移轉,對不對?
王副院長惠鈞:是。
管委員碧玲:所以就不受中央研究院科技移轉利益衝突迴避處理原則第二條的規範,是不是?
王副院長惠鈞:是。
管委員碧玲:這樣瞭解了嗎?
王副院長惠鈞:是,瞭解。
管委員碧玲:所以這300萬股理應不須揭露,理應不受利益衝突迴避處理原則之影響,是不是?
王副院長惠鈞:照這樣的分析是。
管委員碧玲:對!這是第一階段,當然還有第二階段的問題。翁啟惠有沒有內線交易?不知道,如果有就要受國法之制裁,如果沒有就要還他清白。只是目前到底有或沒有,那一塊我沒辦法在這裡跟您釐清,但至少您在這裡替我釐清的是,這300萬股與中研院無關,所以不受中央研究院科技移轉利益衝突迴避處理之規範。
本席在此還是要向中研院、科技部及所有與技術移轉業務相關的所有單位再次提出懇求與呼籲,你們太爛了!把法律保留的業務都停留在法規命令,都停留在行政命令!你們知道現在出了什麼問題嗎?以中研院這些技術移轉辦法來說,母法是科技基本法,法律保留業務的母法雖然是科技基本法,但是你並沒有納入科技基本法中的技術移轉專章,你們把它變成法規命令時,它就完全沒有罰則,今天是這300萬股不受它的規範哦!如果受它的規範,有沒有罰則?沒有罰則耶!而且當全國人民用公職人員利益衝突迴避法、貪污治罪條例的觀念來看待這個問題時,有沒有錯?好像也沒有錯,因為他們是法律位階,而你這個是法規命令,所以當然是用法律位階、用最高的標準來要求公務員,而不是技術移轉的相關制度。所以這就是為什麼我一開始談制度的問題,恐怕這個制度真的太不完備了,造成今天這個事件,我們還不知道該怎麼定位,所以今天在這裡我們沒有結論,我們不知道翁院長該負的責任到哪裡,但至少第一,我們用最嚴格的標準來看,他傷害了中央研究院,中研院在這個過程中被大家質疑其公信力,當然也傷害了翁院長他自己。但是在水落石出的那一天,有沒有一種可能,就是其實他在法律體系裡面是被冤枉的?有沒有這種可能?
王副院長惠鈞:有可能。
管委員碧玲:你認為有可能?
王副院長惠鈞:我對此一直有信心,我覺得是有可能的。
管委員碧玲:如果是那樣該怎麼辦?我們折損了一個可能的諾貝爾獎得主,而他很可能是被冤枉的,如果是這樣的話,我們不知道該怎麼承擔這個責任,所以為什麼本席在這整個事件當中急於要去釐清事實、為什麼我不敢加入痛加批判的行列?實在是心之所為。我第一時間在談我們整個法律制度不完備時、我一直說這3,000張股票是跟中研院無關的時候,我還被修理,今天這樣的過程就是按圖索驥,推出來的就是這樣的結果,而我們的結論就是:萬一他是被冤枉的該怎麼辦?當然,這一切都不包括內線交易的部分,因為內線交易的部分,他有可能是違法的,那也是非常重大,但是那個部分我們就不知道了,我今天只是處理與中研院相關的部分。假設我們今天這樣的推論是對的,那中研院好在還了他的清白,副院長,是不是?大家還是要抬頭挺胸哦!因為這是一個誤解,對不對?
王副院長惠鈞:是。
管委員碧玲:所以是可以抬頭挺胸的。我的質詢時間已經超過很多了,但我還是不知道應該怎麼下結論。總之,我真的擔心,萬一冤枉了該怎麼辦?不過,內線交易的部分,我們真的不知道那是什麼,但是關於這個部分,我真的怕是冤枉了他,謝謝!
王副院長惠鈞:謝謝委員的指教。
主席:接下來登記質詢的吳委員秉叡、林委員俊憲、賴委員士葆、盧委員秀燕、曾委員銘宗、吳委員志揚、鄭委員天財、顏委員寬恒、蕭委員美琴、黃委員偉哲、陳委員歐珀、鄭委員運鵬、鍾委員佳濱、徐委員永明、蔣委員乃辛、劉委員櫂豪、吳委員思瑤、周陳委員秀霞、邱委員志偉、何委員欣純、黃委員昭順、羅委員明才、李委員昆澤及廖委員國棟均不在場。
請林委員淑芬質詢。
林委員淑芬:主席、各位列席官員、各位同仁。次長,你對臨床試驗的制度面有所掌握嗎?
主席:請衛福部許次長答復。
許次長銘能:主席、各位委員。有。
林委員淑芬:是你管理的嗎?
許次長銘能:是。
林委員淑芬:現在林奏延次長離開了,你既管藥也管醫,然後什麼都會,全才和全能!政府對於臺灣生技產業和新藥發展的態度,其實是非常鼓勵的,他排除了所有障礙並期許臺灣能有所謂生技產業這麼一回事,所以在臨床試驗上是朝向不斷的解除管制。今年2月底前次長林奏延投書聯合報,他說他到衛福部任職後發現,臺灣多國多中心臨床試驗案件的數量逐年下降,主要是醫院人體試驗委員會的審查速度太慢,所以衛福部做了一些改革,將衛福部補助成立臨床試驗中心的9家醫院,設立成為「聯合人體試驗委員會」的主審醫院,規定臨床試驗的審查要在幾天內完成,你知道嗎?
許次長銘能:好像是20天。
林委員淑芬:20天一定要完成,交回執行醫院人體試驗委員會時,用簡審即可。在大家通力合作下,已大幅縮短人體試驗委員會的審查流程,主審醫院審查時間縮短至9.9天,新藥臨床試驗案件也增加24%。
臺灣近十多年來,在醫事司及醫策會大力輔導及各醫院努力及自律下,各醫院的人體試驗委員會已十分健全,衛福部也考慮比照美國食品藥物管理局方式,受試對象除了兒童、弱勢、易受傷害族群(像孕婦)等以外,放寬委由各醫院人體試驗委員會審查,結果報請核備即可。但是我們不能忘記,人體試驗的最核心是在於保護受試者權益,這個前題是不能減損的。所以我們看得出來,林次長投書聯合報,他大方承認20天就可以跑完一個審查,如果主審醫院審自己醫院的人體試驗,審查時間為9.9天。2013年6月1日到年底成立了一個IRB的主審中心,協助審查作業,然後就開始正式實施了。衛福部成立C-IRB(主審中心)就是希望透過主審醫院加快審查速度,讓新藥的臨床試驗可以快速通關。本來的審查制度是自己的醫院自己收案,自己審自己的病人和個案,因為是你自己醫院的臨床試驗,是你自己醫院的病人,你會清楚掌握他的狀況,所以你對他會有多一點的受試保護,但是在成立C-IRB之後,你開放其他醫院也可以來審查別人的醫院,你們要快又要簡易審查,審查密度加快,審查密度放低,還規定20天以內要完成審查,那我們就要問,受試者的風險誰把關?對於受試者的風險,有何把關機制?
許次長銘能:對於審查這件事,我們找的這些主審醫院大部分是醫學中心,對臨床試驗的執行非常有經驗的醫院來負責主審,也是在嚴謹的情況下去做這部分的審查,而且IRB這一塊每年要經過醫策會、每3年要經過相關審議,除此之外,相關審議通過的臨床試驗計畫還要送到衛福部,若它是醫療器材或藥品,也要送到FDA做相關行政的審查,至於臨床醫療技術的部分,也要送醫事司相關醫事委員會做審查。
林委員淑芬:說是這樣說,但你不要忘了,今年1月27日你們才偷偷公告要修改人體試驗管理辦法第三條草案,放寬將受試者同意書由倫理審查委員會(IRB)審查即可,原本是IRB審查後還要送衛福部,結果現在只要由倫理審查委員會(IRB)審查就好了,可是過去「受試者同意書」都必須連同人體試驗計畫,送中央主管機關申請核准。此舉無疑為中央主管機關衛生福利部迴避責任的作法,因為你們把倫理把關或相關專業把關都委託出去,交付給外面的各大醫院,可是各大醫院本身又接受業者的委託試驗,然後還要審查自己的臨床試驗成功與否。我的意思是說,在開放後醫院不光是可以審查自己的,還可以審別人的,各家醫院可以自行決定如何審案,以及審案的快慢、難易、資料是否詳細、有無科學性、試驗的風險與利益合理與否、是否具備知情同意、利益有沒有衝突、有沒有狀況需要迴避,本來是這樣子,但是卻放寬到快點審、快點審,根本不論是否達到受試者保護的前提,只是放寬別的醫院也可以審別人的,而且還限定時間,這讓我們真的很害怕,因為一個沒有受試者保護倫理規範嚴謹把關的人體試驗,就等於人體試驗的信度及相關可靠性會備受質疑。
許次長銘能:這個部分的公告,其實我們有蒐集各界的意見,針對開放的部分,現在並沒有說要……
林委員淑芬:你都模糊兩句就帶過,請問人體試驗管理辦法第三條草案,你們現在準備怎麼做?
許次長銘能:維持目前暫時的……
林委員淑芬:怎麼會是FDA署長在旁邊告訴你呢?人體試驗管理辦法的母法依據是哪一個法?
許次長銘能:母法是醫療法。
林委員淑芬:醫療法的業務主管機關是FDA嗎?
許次長銘能:不是,是醫事司。
林委員淑芬:對嘛!可是醫事司司長卻不在現場,今天我們要討論新藥、人體試驗等議題,醫事司司長根本沒有來,你的小抄還是FDA署長提供給你的,你不要忘了,人體試驗是依循醫療法這部母法而來的,如果你要當一個全知全能、什麼都會、一百分的次長,等於是地下部長了,那就請你準備充分一點。請你回答我,現在你們修正人體試驗管理辦法第三條草案,到底是要維持原狀還是真的要修正?
許次長銘能:目前是維持原狀。
林委員淑芬:把政府最終把關的角色給拿掉,還是真的要直接委由既是球員又是裁判的醫院人體IRB審查?
許次長銘能:目前是維持現況。
林委員淑芬:但願如此!但願如此!以前都必須送中央主管機關申請核准,結果你們在今年1月27日偷偷把它拿掉,政府只想把政府、國家該做的,以及該盡到保護國民的責任給丟掉,從這個修訂法規的過程來看,政府都不想當政府了。你們不斷加速試驗,請問受試者健康安全的權益在哪裡?本席要提醒你,試驗就是試驗,它不是治療,衛福部不要以治療的名義來掩蓋這些產業界本質上就是在做人體試驗,拿病人的身體當成實驗的手段與工具,這個本質絕對不能夠被忘掉。更不要講人體試驗管理辦法第三條之一的修正,請你們務必在倫理上、利益衝突上及受試者保護上好好想清楚。
原本藥廠必須花錢請人家當他們的試驗對象,受試就是花錢找人來幫它測試,才能通過臨床試驗一期、二期、三期、四期,現在你們修正人體試驗管理辦法第三條之一後,在它還不能上市以前,還沒有通過臨床實驗的二期、三期前就可以收費,被它拿來試驗的白老鼠病人還要付錢給藥廠,它不但不用付錢給受試者,而是受試者要付錢給藥廠,它不用等測試通過就可以賣藥,這些狀況是因為你們去放寬的關係,基本上這是一件非常大的事情,姑且不論某種療法是不是有效,或是某種疫苗是不是真的是萬靈丹,但國家、政府做這些事情可以這麼潦草,沒有公開公聽,沒有廣徵民意,沒有讓學界、其他專業團體討論的餘地,就直接公告修正,本來預告完就要公告,我們真的是很害怕!受試者有二種,一種是病到無藥可醫,希望醫師趕快給他藥,他願意試,另一種是專業的受試者,請問你知道誰是專業的受試者嗎?次長,你有沒有勾勒出臺灣受試族群的樣貌,誰是受試者?誰是專業、專門在當藥品試驗的受試者?你知不知道有一種人在當專業的受試者?
許次長銘能:我想受試者在他們提出相關的臨床試驗計畫裡面,一定有一些特定的對象,對於這些對象的選取,都要符合臨床試驗的相關規範,這部分依照……
林委員淑芬:你說的都是空話,各種藥廠、各種新藥、各種臨床試驗,做了這麼多年,對每一個受試者還有倫理審查基本資料掌握,你們對這些專業的受試者有沒有一點關心啊?如果你們在乎這一群受試者,應該就會如同英國在2008年針對第一期臨床試驗受試者的調查,該調查發現,參與試驗的族群中,全職工作者占23%,無業者占22%,窮學生占25%,退休以後沒有老年經濟生活保障的人占了19%,從這個數據中,可以看到無業者和學生等經濟弱勢者、社會弱勢者的比例占了一半以上。簡單來講,在我唸書的時候,我的好朋友就曾經去當過人體試驗的試藥者,他試了這一家又試了另一家,即使規定不可以做他還是去試也沒有人知道,因為他是為了領取臨床試驗的營養費、車馬費而參與試驗,目的就是為了賺錢,簡單講就是為了謀生、為了活下去。
印度的情形又是如何?根據2015年12月17日中央社新聞指出,印度社會科學研究理事會(ICSSR)工業發展研究所研究員孟代爾(Swadhin Mondal)指出,印度許多受測者都是文盲,多數因金錢或免費醫療被誘惑接受參加臨床實驗,他們往往不知道參與試驗的風險。所以我才會問次長,衛福部做這麼久了,有這麼多的臨床、這麼多的試驗者,你們到底在不在乎這些受試者?知不知道他們到底是為什麼來做試驗?受試者的樣貌是什麼?長得什麼樣子?是不是跟外國同樣的特質?你們有沒有後續的追蹤與調查,你們在不在乎他們這一輩子做過幾次的人體試驗、藥品試驗?後來的健康風險有沒有比平常人更增加?你們從來沒有!反而不停的放寬對受試者的保護,不停的加快審查速度,從不過問審查得好不好、有沒有落實對受試者的保護,如果拖延到審查時間,就說這樣會延宕生技產業的發展,所以這是不行的。
結果我們必須從社會新聞去瞭解受試者的狀況,請你們看一下蘋果日報2014年09月11日《大學生搏命打工人體實驗2天打20針》的報導,請問這叫做IRB審查機制在做把關嗎?你說過他們的資格都有匡定,符合才可以試驗嗎?這就是你們真正的現實,把關機制都是玩弄書面審查,都是假的!我們要求衛福部應該針對最基礎的受試者同意書有記載的資料,如臨床試驗的期別統計受試者人數,以及人體試驗針對新醫材、新醫療技術、學名藥三者統計受試者人數進行統計,另外還要再委託研究這群受試者後來的健康風險究竟怎麼樣,該做的都要做,編列這筆預算,進行這些資料的統計,可不可以?
許次長銘能:謝謝委員的建議,對於第一期,也就是健康人受試者的部分,我們或許可以研擬一個相關研究計畫來做後續的追蹤。
林委員淑芬:第一期是最少的。
許次長銘能:對,二、三期是因為本身有病,需要檢驗藥品的療效,所以一定會找一些特定的對象來接受試驗。
林委員淑芬:請你們針對不同的期別、不同的風險、不同的屬性、不同的管制做出不同的調查與研究。
許次長銘能:二、三期的部分本來就是要針對安全性及療效部分進行追蹤。
林委員淑芬:立法院第七屆曾有立委提案,要求衛福部宣導受試者權益,當時你們成立了一個受試者權益的網站,結果委員屆期不在了,網站、網頁也不知道從什麼時候開始消失了。如果有人想要參與人體臨床試驗,他除了醫院提供的資料外,他可以去哪裡搜尋受試者權益的資訊?衛福部是否應重新建立宣導受試者權益的平台媒介,讓它復活?
許次長銘能:有關權益的部分,我們其實是委由相關單位去做相關的宣導。
林委員淑芬:你講的好像現在都沒有問題,我現在告訴你現在就是沒有,不要再說你們以前做什麼了,我要聽的是你們未來要不要改善啦!
許次長銘能:我們會去加強受試者權益保障的相關宣導。
林委員淑芬:受試者發生不良反應,你們如何處理?
許次長銘能:不良反應的部分,在整個試驗計畫裡面一定有非常嚴謹的機制可以做處理。
林委員淑芬:你們到底有沒有主動關心過醫院在發生不良反應時後續的處理情形?有沒有處理過?
許次長銘能:這個部分我們會……
林委員淑芬:有沒有介入過我想你應該不知道,但有沒有處理過?有沒有主動到醫院關心過?
許次長銘能:有。
林委員淑芬:有?醫院是怎麼處理的?
許次長銘能:一定要針對不良反應的部分……
林委員淑芬:請你白紙寫黑字將這10年來所有不良反應的件數、醫院的後續追蹤處理、如何處理等資料整理出來,如果發生不良反應能不能領取藥害救濟?
許次長銘能:這部分不在藥害救濟的範圍,臨床試驗這一塊,不良反應的部分最後都要送到……
林委員淑芬:如果出現不良反應是要自己付出代價還是醫院會有賠償?由於醫院希望接到很多藥廠的試驗案,所以不良反應不能太多,以免藥廠不委託它做,在這種情況下,醫院如何對受試者的不良反應去球員兼裁判呢?你怎麼可以直接委託醫院呢?醫院有這樣的案例也要壓下來啊!如果不壓下來,不良反應就會太多,人家就不會委託他們做了,怎麼辦?
許次長銘能:這部分我們一定會透過實際查核……
林委員淑芬:你們有什麼管理配套?
許次長銘能:每間醫院在執行臨床試驗時,我們都要做所謂的實際查核,看看臨床所蒐集的相關資訊……
林委員淑芬:我現在就是要告訴你,因為你根本講不出來,你現在都沒有辦法精準的回答我一年究竟是做幾次,醫院查核裡面不良反應有多少個案,更不要提壓下來的黑數了,是不是只要沒有死統統都沒有關係?這位受試者領了一大筆錢,二天領了1、2萬元,可是一輩子要付出多大的代價,等到他付出代價時,可以申請職業災害賠償嗎?我告訴你,這不是開玩笑的,不要忘了今年1月15日,法國才發生嚴重的人體臨床試驗事故,之後法國的中央主管機關針對臨床試驗中發生不良反應的部分成立調查機制,你知道當時死了幾個人嗎?幾個人住院、幾個人腦死?你不知道。
主席:林委員,你的時間到了。
林委員淑芬:抱歉,我快結束了,後面不是沒有人了嗎?
主席:大家質詢的時間是公平的,謝謝。
林委員淑芬:這不是公平的問題,開會時間是開到5點半,那我現在可以立即登記第二輪的發言嗎?為什麼委員認真開會卻要被人家趕下台,如果你覺得會影響到其他委員,可是後面沒有任何委員啊!
主席:前面發言的委員都有時間的限制。
林委員淑芬:我為什麼要調到最後?我可以馬上下台,但我要登記第二輪的發言,可以嗎?
主席:可以儘快結束你的質詢嗎?謝謝。
林委員淑芬:次長,今年1月15日,法國發生嚴重的人體試驗事故,在法國進行的一項新藥臨床試驗演變成悲劇,造成6個人住院,其中1人腦死亡,另外還有3人可能會留下不可逆轉的後遺症。法國國家藥物暨健康產品安全局(ANSM)認為,這是法國歷來相關領域的最嚴重事故。當然我們並沒有出現類似的不良反應事件,這是我們的幸運,但我們看到其他國家的前車之鑒,要不要在制度面上做好設計,並建立防弊機制,包括內控防弊與外控防弊?你不能讓醫院球員兼裁判,自己把關,人家跟它反映,醫院就塞一點錢出來和解,有沒有可能?有啊!
許次長銘能:臨床所做的試驗相關報告全部都要送到衛福部來審查,針對這個部分,我們也會實際到各家醫院去做瞭解……
林委員淑芬:你們進行的書面審查,甚至不斷的偷改法令,要把衛福部的審查把關機制拿掉,全部交給醫院,你不要忘了,這裡有一份曾經在人體試驗委員會擔任委員多年的學者所寫的paper,名稱是「研究倫理審查的常見爭議」,他指出計畫書的科學性不足、試驗的風險與利益不合理、知情同意的欠缺、對易受傷害受試者的忽略、未合理處理利益衝突的問題等等,這就是在醫院裡面擔任IRB委員多年的學者發表在「應用倫理評論」裡面的文章,名稱是「研究倫理審查的常見爭議」,你不要告訴我還要送衛福部審查,那是胡說八道的,那是在睜眼說瞎話,而且許次長也搞不清楚,我問你一件事情好了,刑警大隊有沒有在……
主席:林委員,你的發言時間已經23分鐘了,拜託一下,謝謝。
林委員淑芬:我可不可以登記第二輪發言?
主席:本席等一下會做裁示。
林委員淑芬:我覺得不盡合理,因為我們的開會時間明明是要開到5點半,別的委員不來質詢,是他們自己放棄權利,但我還想要質詢啊!
主席:但這樣質詢下去,1個小時可能都不夠。
林委員淑芬:但是我抗議啊!今天衛福部不應該由一位不專業的次長列席,在不準備充足的狀況下來跟我們討論公共政策、公共管理的議題與法案,然後又在這邊打太極拳式的回答,這不僅僅是對立委不尊重,對人民更不負責任,今天我很嚴肅在談這一個問題,結果他沒辦法講出確切的答案,令人相當遺憾,謝謝。
主席:報告委員會,本日會議報告及詢答完畢。
林委員俊憲所提書面質詢,列入紀錄,刊登公報,並請書面答復。
委員口頭質詢未及答復部分或請補充資料者,請於二週內答復,委員另要求期限者,從其所定。
林委員俊憲書面質詢:
本席懷疑浩鼎案沸沸揚揚,是國民黨高官在幕後操盤,除政治盤算外,又可趁此機會打壓浩鼎股價,放空坑殺股民。
臺灣浩鼎生技公司前十大股東之一的「永豐商銀託管薩摩亞全球策略公司投資專戶」代表人,竟是前國民黨高官、馬政府國策顧問楊世緘。從2012年持股四千張,為第十大股東開始,截至2015年止,竟更換3家公司名稱,躍升第八大股東。本席嚴重懷疑是為了隱藏敏感身分,化身浩鼎股東隱形人,挾黨及行政優勢,伸黑手影響浩鼎股價坑殺股民!
浩鼎借券成交量也令人匪夷,在「議借」借券欄目裡頭,成交費率竟都只有0.01%,換言之,被借券人只賺將近零的利息,但擁有大量借券能力的浩鼎股東,屈指可數,背後是誰在玩借券遊戲,政府應嚴查以昭公信!楊世緘舅父為前中共國家副主席榮毅仁,實在令人非常憂心臺灣浩鼎生技公司已受中國影響,將間接扼殺、掠奪臺灣生技產業,甚至結合政客及有心人士狂打「浩鼎案」,其目的就是要打擊臺灣生技產業、坑殺無辜股民!本席呼籲金管會不可怠惰,應回歸專業嚴查借券放空之情事,保障基本公平正義!
主席:今日會議到此結束,現在散會。
散會(14時48分)