
主席:請問院會,對以上協商結論有無異議?(無)無異議,本案逐條討論時逕依協商結論處理。
現在進行逐條討論。
文化創意產業發展法部分條文修正草案(二讀)
主席:第三條維持現行條文。
請宣讀第五條。
第 五 條 本法所稱主管機關:在中央為文化部;在直轄市為直轄市政府;在縣(市)為縣(市)政府。
主席:第五條照審查會條文通過。
宣讀第七條。
第 七 條 為提升文化內容之應用及產業化,促進文化創意產業發展,政府得以專責法人辦理相關業務。
主席:第七條照審查會條文通過。
宣讀第三十條。
第三十條 本法施行日期,由行政院另定之。
本法中華民國一百零七年十二月二十五日修正之條文,自公布日施行。
主席:第三十條照審查會條文通過。
本案已全部經過二讀,現有民進黨黨團提議繼續進行三讀,請問院會,有無異議?(無)無異議,請宣讀經過二讀之條文。
文化創意產業發展法修正第五條、第七條及第三十條條文(三讀)
─與經過二讀內容同,略─
主席:三讀條文已宣讀完畢,請問院會,對本案有無文字修正?(無)無文字修正意見。
本案決議:文化創意產業發展法第五條、第七條及第三十條條文修正通過。
進行討論事項第十一案。
十一、本院司法及法制、教育及文化兩委員會報告審查行政院函請審議「文化內容策進院設置條例草案」案。(本案經提本院第9屆第6會期第9次會議討論決議:協商後再行處理。爰於本次會議繼續討論。)
主席:本案經第6會期第9次會議討論決議:協商後再行處理。現已完成協商,請宣讀協商結論。

協商主持人:段宜康
協商代表:鄭運鵬 許智傑 鍾佳濱 黃國書 李俊俋 柯建銘 尤美女 吳思瑤 何欣純 管碧玲 柯志恩 李彥秀 林德福(李彥秀代)
曾銘宗(李彥秀代) 高金素梅 李鴻鈞 黃國昌
高潞‧以用‧巴魕剌Kawlo.Iyun.Pacidal


主席:請問院會,對以上協商結論有無異議?(無)無異議,通過,本案逐條討論時逕依協商結論處理。
現在進行逐條討論。
文化內容策進院設置條例草案(二讀)
主席:宣讀名稱。
名 稱:文化內容策進院設置條例
主席:名稱照審查會名稱通過。
宣讀第一章章名。
第 一 章 總則
主席:第一章章名照審查會章名通過。
宣讀第一條。
第 一 條 為提升文化內容之應用及產業化,促進文化創意產業發展,特設文化內容策進院(以下簡稱本院),並制定本條例。
主席:第一條照審查會條文通過。
宣讀第二條。
第 二 條 本院為行政法人;其監督機關為文化部。
主席:第二條照審查會條文通過。
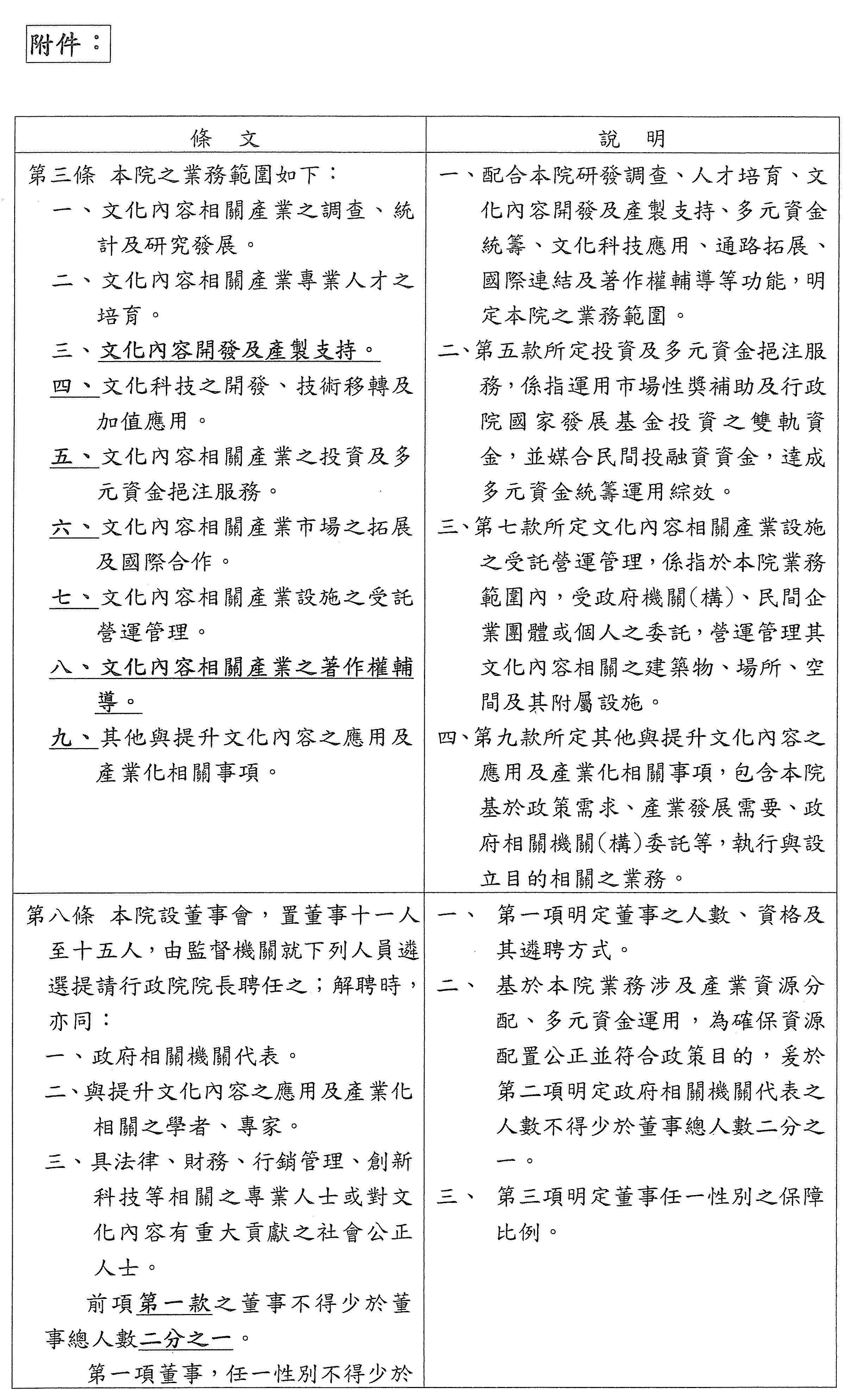
宣讀第三條協商條文。
第 三 條 本院之業務範圍如下:
一、文化內容相關產業之調查、統計及研究發展。
二、文化內容相關產業專業人才之培育。
三、文化內容開發及產製支持。
四、文化科技之開發、技術移轉及加值應用。
五、文化內容相關產業之投資及多元資金挹注服務。
六、文化內容相關產業市場之拓展及國際合作。
七、文化內容相關產業設施之受託營運管理。
八、文化內容相關產業之著作權輔導。
九、其他與提升文化內容之應用及產業化相關事項。
主席:第三條照協商條文通過。
宣讀第四條。
第 四 條 本院經費來源如下:
一、政府之核撥及捐(補)助。
二、國內外公私立機構、團體及個人之捐贈。
三、受託研究及提供服務之收入。
四、營運及產品之收入。
五、其他收入。
前項第二款之捐贈,視同對政府之捐贈。
主席:第四條照審查會條文通過。
宣讀第五條。
第 五 條 本院應訂定組織章程、人事管理、會計制度、內部控制、稽核作業及其他規章,提經董事會通過後,報請監督機關備查。
本院就其執行之公共事務,在不牴觸有關法律或法規命令之範圍內,得訂定規章,並提經董事會通過後,報請監督機關備查。
主席:第五條照審查會條文通過。
宣讀第六條。
第 六 條 本院應建立公民參與機制,廣納社會各界建言及意見,並回應或說明。
主席:第六條照審查會條文通過。
宣讀第七條。
第 七 條 本院每年應舉行諮詢會議,邀請文化內容相關學者專家及產業、團體、法人與機構之代表,就本院發展與業務等相關事項,提供諮詢意見;諮詢會議之過程應全程公開。
前項參與會議之學者專家或代表,其組成成員應兼顧性別、族群、地域、社會階層及黨派之平衡。
主席:第七條照審查會條文通過。
宣讀第二章章名。
第 二 章 組織
主席:第二章章名照審查會章名通過。
宣讀第八條協商條文。
第 八 條 本院設董事會,置董事十一人至十五人,由監督機關就下列人員遴選提請行政院院長聘任之;解聘時,亦同:
一、政府相關機關代表。
二、與提升文化內容之應用及產業化相關之學者、專家。
三、具法律、財務、行銷管理、創新科技等相關之專業人士或對文化內容有重大貢獻之社會公正人士。
前項第一款之董事不得少於董事總人數二分之一。
第一項董事,任一性別不得少於董事總人數三分之一。
主席:第八條照協商條文通過。
宣讀第九條。
第九條 本院設監事會,置監事三人至五人,由監督機關就下列人員遴選提請行政院院長聘任之;解聘時,亦同:
一、政府相關機關代表。
二、具會計、審計、稽核、法律或管理等相關學識經驗者。
監事應互推一人為常務監事。
第一項監事,任一性別不得少於監事總人數三分之一。
主席:第九條照審查會條文通過。
宣讀第十條。
第 十 條 董事、監事任期為三年,期滿得續聘一次。但續聘人數不得逾總人數二分之一。
代表政府機關出任之董事、監事,應依其職務異動改聘,不受前項續聘次數之限制;依第八條第一項第二款、第三款及前條第一項第二款規定聘任之董事、監事,任期屆滿前出缺者,由監督機關遴選提請行政院院長補聘之,其任期至原任者之任期屆滿為止。
主席:第十條照審查會條文通過。
宣讀第十一條。
第十一條 有下列情事之一者,不得聘任為董事、監事:
一、受監護宣告或輔助宣告尚未撤銷。
二、受有期徒刑以上刑之判決確定,而未受緩刑之宣告。
三、受破產宣告,或依消費者債務清理條例經法院裁定開始清算程序,尚未復權。
四、褫奪公權尚未復權。
董事、監事有前項情形之一者,應予解聘;無故連續不出席董事會會議、監事會會議達三次者,亦同。
董事、監事有下列各款情事之一者,得予解聘:
一、行為不檢或品行不端,致影響本院形象,有確實證據。
二、工作執行不力或怠忽職責,有具體事實或違反聘約情節重大。
三、當屆之本院年度績效評鑑連續二年未達監督機關所定標準。
四、違反公務人員行政中立法之情事,有確實證據。
五、就主管事件,接受關說或請託,或利用職務關係,接受招待或餽贈,致損害公益或本院利益,有確實證據。
六、非因職務之需要,動用本院財產,有確實證據。
七、違反本條例所定利益衝突迴避原則或第十八條第一項特定交易行為禁止之情事,有確實證據。
八、其他有不適任董事、監事職位之行為。
前項各款情形,監督機關於解聘前,應給予當事人陳述意見及申辯之機會。
本院董事、監事之遴聘、解聘、補聘之方式及其他相關事項之辦法,由監督機關定之。
主席:第十一條照審查會條文通過。
宣讀第十二條。
第十二條 本院置董事長一人,由監督機關就董事中提請行政院院長聘任之;解聘時,亦同。
董事長之聘任、解聘、補聘之方式及其他相關事項之辦法,由監督機關定之。
董事長對內綜理本院一切事務,對外代表本院;其因故不能執行職務時,由其指定之董事代行職權,不能指定時,由董事互推一人代行職權。
董事長初任年齡不得逾六十五歲,任期屆滿前年滿七十歲者,應即更換。但有特殊考量,經行政院核准者,不在此限。
主席:第十二條照審查會條文通過。
宣讀第十三條。
第十三條 董事會之職權如下:
一、發展目標及計畫之審議。
二、年度業務計畫之審議。
三、經費之籌募與財產之管理及運用。
四、年度預算、決算及績效目標之審議。
五、規章之審議。
六、自有不動產及無形資產之處分或其設定負擔之審議。
七、院長之任免。
八、年度整體多元資金統籌計畫之審議。
九、組織擴編事項之審議。
十、本條例所定應經董事會決議事項之審議。
十一、其他重大事項之審議。
主席:第十三條照審查會條文通過。
宣讀第十四條。
第十四條 董事會每三個月開會一次;必要時,得召開臨時會議,由董事長召集,並擔任主席。
董事會會議應有過半數董事之出席,其決議應有出席董事過半數之同意。但前條第一款至第十款之決議,應有董事總人數過半數之同意。
主席:第十四條照審查會條文通過。
宣讀第十五條。
第十五條 監事會之職權如下:
一、年度業務決算之審核。
二、業務、財務狀況之監督。
三、財務帳冊、文件及財產資料之稽核。
四、其他重大事項之審核或稽核。
監事單獨行使職權,常務監事應代表全體監事列席董事會會議。
主席:第十五條照審查會條文通過。
宣讀第十六條。
第十六條 董事、監事、常務監事應親自出席、列席董事會會議、監事會會議,不得委託他人代理出席。
主席:第十六條照審查會條文通過。
宣讀第十七條。
第十七條 董事、監事應遵守利益衝突迴避原則,不得利用職務上之權力、機會或方法,圖謀本人或關係人之利益;其利益衝突迴避之範圍及違反時之處置,由監督機關定之。
董事、監事相互間,不得有配偶及三親等以內血親、姻親之關係。
本條例所稱關係人,指配偶或二親等以內之親屬。
主席:第十七條照審查會條文通過。
宣讀第十八條。
第十八條 董事、監事或其關係人,不得與本院為買賣、租賃、承攬等交易行為。
違反前項規定致本院受有損害者,行為人應對其負損害賠償責任。
主席:第十八條照審查會條文通過。
宣讀第十九條。
第十九條 本院之董事長得為專任或兼任,專任者之報酬由監督機關核定之;兼任者為無給職。
本院董事、常務監事及監事,均為無給職。
主席:第十九條照審查會條文通過。
宣讀第二十條。
第二十條 本院置院長一人,由董事長提請董事會通過後聘任之;解聘時,亦同。院長受董事會之指揮、監督,執行本院業務,並應列席董事會會議。
第十一條第一項至第四項、第十二條第四項、第十七條、第十八條、第二十一條第二項、第三項、第二十二條第六款有關董事及董事長之規定,於依前項規定所置院長準用之。
主席:第二十條照審查會條文通過。
宣讀第二十一條。
第二十一條 本院進用之人員,依本院人事管理規章辦理,不具公務人員身分;其權利義務關係,應於契約中明定。
董事、監事之配偶及其三親等以內血親、姻親,不得擔任本院總務、會計及人事職務。
董事長不得進用其配偶及三親等以內血親、姻親,擔任本院職務。
主席:第二十一條照審查會條文通過。
宣讀第三章章名。
第 三 章 業務及監督
主席:第三章章名照審查會章名通過。
宣讀第二十二條。
第二十二條 監督機關對本院之監督權限如下:
一、發展目標及計畫之核定。
二、規章、年度業務計畫與預算、年度執行成果及決算報告書之核定或備查。
三、財產及財務狀況之檢查。
四、業務績效之評鑑。
五、董事、監事之遴聘、解聘及建議。
六、董事、監事於執行業務違反法令時,得為必要之處分。
七、本院有違反憲法、法律、法規命令時,予以撤銷、變更、廢止、限期改善、停止執行或其他處分。
八、自有不動產及無形資產之處分或其設定負擔之核可。
九、年度整體多元資金統籌計畫之核可。
十、其他依法律所為之監督。
主席:第二十二條照審查會條文通過。
宣讀第二十三條。
第二十三條 監督機關應邀集有關機關代表、學者專家及社會公正人士,辦理本院之績效評鑑,其中學者專家及社會公正人士之人數不得少於三分之二,且任一性別不得少於總人數三分之一。
前項績效評鑑之方式、程序及其他相關事項之辦法,由監督機關定之。
績效評鑑之內容如下:
一、本院年度執行成果之考核。
二、本院業務績效及目標達成率之評量。
三、本院年度自籌款比率達成率。
四、本院經費核撥之建議。
五、其他有關事項。
主席:第二十三條照審查會條文通過。
宣讀第二十四條。
第二十四條 本院應擬訂發展目標及計畫,提經董事會通過後,報請監督機關核定。
本院應訂定年度業務計畫及預算,提經董事會通過後,報請監督機關備查。
主席:第二十四條照審查會條文通過。
宣讀第二十五條。
第二十五條 本院於會計年度終了後三個月內,應將年度執行成果及決算報告書,委託會計師查核簽證,提經董事會審議,並經監事會通過後,報請監督機關備查,並送審計機關。
前項決算報告書,審計機關得審計之;審計結果,得送監督機關或其他相關機關為必要之處理。
主席:第二十五條照審查會條文通過。
宣讀第四章章名。
第 四 章 會計及財務
主席:第四章章名照審查會章名通過。
宣讀第二十六條。
第二十六條 本院之會計年度,應與政府會計年度一致。
本院之會計制度應依行政法人會計制度設置相關法規訂定。
本院財務報表,應委請會計師進行查核簽證。
主席:第二十六條照審查會條文通過。
宣讀第二十七條。
第二十七條 本院成立年度之政府核撥經費,得由監督機關在原預算範圍內調整因應,不受預算法第六十二條及第六十三條規定之限制。
主席:第二十七條照審查會條文通過。
宣讀第二十八條協商條文。
第二十八條 本院設立時,因業務有必要使用之公有財產,得由政府機關(構)採捐贈、出租或無償提供使用等方式為之。
本院設立後,得因業務需要,價購公有不動產。土地之價款,以當期公告土地現值為準。地上建築改良物之價款,以稅捐稽徵機關提供之當年期評定現值為準;無該當年期評定現值者,依公產管理機關估價結果為準。
本院設立後因受託營運管理文化內容相關產業設施之需要,公有財產得由政府機關(構)採捐贈、出租或無償提供使用等方式為之。
採第一項及前項之捐贈者,不適用預算法第二十五條、第二十六條及國有財產法第二十八條、第六十條相關規定。
本院以政府機關核撥經費指定用途所購置之財產,為公有財產。
第一項、第三項出租、無償提供使用及前項之公有財產以外,由本院取得之財產為自有財產。
第一項、第三項無償提供使用及第五項之公有財產,由本院登記為管理人,所生之收益,列為本院之收入,不受國有財產法第七條第一項規定之限制;其管理、使用、收益等相關事項之辦法,由監督機關定之。
公有財產用途廢止時,應移交各級政府公產管理機關接管。
本院接受捐贈之公有不動產,不需使用時,應歸還原捐贈機關,不得任意處分。
主席:第二十八條照協商條文通過。
宣讀第二十九條。
第二十九條 政府機關核撥本院之經費,應依法定預算程序辦理,並受審計監督。
政府機關核撥之經費超過本院當年度預算收入來源百分之五十者,應由監督機關將本院年度預算書,送立法院審議。
本院自主財源及其運用管理相關事項,由本院訂定收支管理規章,報請監督機關備查。
主席:第二十九條照審查會條文通過。
宣讀第三十條。
第三十條 本院所舉借之債務,以具自償性質者為限,並應先送監督機關核定。預算執行結果,如有不能自償之虞時,應即檢討提出改善措施,報請監督機關核定。
主席:第三十條照審查會條文通過。
宣讀第三十一條。
第三十一條 本院之採購作業,應本公開、公正之原則,除符合我國締結之條約、協定或政府採購法第四條所定情形,應依各該規定辦理外,不適用政府採購法之規定;其採購作業實施規章,應報請監督機關核定。
前項應依政府採購法第四條規定辦理之採購,於其他法律另有規定者,從其規定。
主席:第三十一條照審查會條文通過。
宣讀第三十二條。
第三十二條 本院之相關資訊,應依政府資訊公開法相關規定公開之;其年度財務報表、年度業務資訊及年度績效評鑑報告,應主動公開。
前項年度績效評鑑報告,應由監督機關提交分析報告,送立法院備查。必要時,立法院得要求監督機關首長率同本院之董事長、院長或相關主管至該院報告營運狀況並備詢。
主席:第三十二條照審查會條文通過。
宣讀第五章章名。
第 五 章 附則
主席:第五章章名照審查會章名通過。
宣讀第三十三條。
第三十三條 對於本院之行政處分不服者,得依訴願法之規定,向監督機關提起訴願。
主席:第三十三條照審查會條文通過。
宣讀第三十四條。
第三十四條 本院因情事變更或績效不彰,致不能達成設立目的時,由監督機關提請行政院同意後解散之。
本院解散時,其人員應終止契約;其賸餘財產繳庫;其相關債務由監督機關概括承受。
主席:第三十四條照審查會條文通過。
宣讀第三十五條。
第三十五條 本條例施行日期,由行政院定之。
主席:第三十五條照審查會條文通過。
報告院會,全案經過二讀,現有民進黨黨團提議繼續進行三讀。請問院會,有無異議?(無)無異議,通過。
現在繼續進行三讀。宣讀。
文化內容策進院設置條例(三讀)
─與經過二讀內容同,略─
主席:三讀條文已宣讀完畢,請問院會,對本案有無文字修正?(無)無文字修正意見。
本案決議:文化內容策進院設置條例草案修正通過。
繼續處理黨團協商所作之附帶決議。
附帶決議:
有鑑於原住民族傳統文化逐漸流失,為加強保障原住民族傳統智慧創作之文化創意產業,文化內容策進院應重視辦理上開相關業務。
主席:請問院會,對以上附帶決議有無異議?(無)無異議,決定:照案通過。
本案完成立法程序後,有委員登記發言。請吳委員思瑤發言。
吳委員思瑤:(11時24分)主席、各位同仁。所有的公民朋友!今天是聖誕節,非常感謝立法院同仁的共同努力,給了臺灣文創產業一份最好的聖誕禮物。我們剛剛通過了文化創意產業發展法修正案,而在此時,文化內容策進院設置條例也同步完成立法,做為一個文化的立法工作者,更是一個文化的愛好者,此刻的心情就像嫁女兒。文化產業過去是我們悉心照料的一個好女兒、乖女兒,但是女兒長大了,就要讓她有更多的能量、更好的養分,去飛、去闖。從今天開始,我們就要將臺灣文創產業的發展及未來託付給文策院。韓國2009年成立了韓國內容振興院,法國也有國家電影及動態影像中心,臺灣亟須建立像文策院這樣一個中介組織,透過專業的治理,引進參與式的機制,協助政府達成文化產業扶植的公共任務,以文化內容來推動臺灣新一波的產業創新升級。未來有了文策院,我們將能以推升產業生態系為出發,短期引進民間投資,長期建構文化金融體系,同時我們將透過文化科技授權的平台,開發更多原生文化內容。我更期待在文策院的領航下,我們會打造一支非常堅強的臺灣隊,進行國際布局,建構台灣文化的國家品牌。身為教文會的召委,排審這個案子,非常榮幸,再次感謝大家,聖誕快樂!
主席:進行討論事項第十二案。
十二、(一)本院社會福利及衛生環境委員會報告併案審查行政院函請審議、親民黨黨團、委員黃秀芳等17人、委員王育敏等16人、委員劉建國等16人分別擬具「醫療器材管理法草案」及委員吳焜裕等25人擬具「醫療器材法草案」案。(本案經提本院第9屆第4、6、6、5、4、6會期第15、4、3、10、14、3次會議報告決定:交社會福利及衛生環境委員會審查。茲接報告,爰於本次會議提出討論。)
(二)本院委員陳曼麗等17人擬具「醫療器材管理法草案」,請審議案。(本案經提本院第9屆第6會期第13次會議決定:自社會福利及衛生環境委員會抽出逕付二讀,與相關提案併案協商。爰於本次會議提出討論。)
主席:現在宣讀審查報告。
(一)、
社會福利及衛生環境委員會函
受文者:議事處
發文日期:中華民國107年11月1日
發文字號:台立社字第1074501639號
速別:普通件
密等及解密條件或保密期限:
附件:如說明二,附件0,附件1
主旨:院會交付審查行政院函請審議「醫療器材管理法草案」、親民黨黨團擬具「醫療器材管理法草案」、委員黃秀芳等17人擬具「醫療器材管理法草案」、委員王育敏等16人擬具「醫療器材管理法草案」、委員劉建國等16人擬具「醫療器材管理法草案」、委員吳焜裕等25人擬具「醫療器材法草案」等6案,業經併案審查完竣,須經黨團協商,復請查照,提報院會公決。
說明:
一、復貴處107年02月27日台立議字第1070700003號、107年10月23日台立議字第1070703826號、107年10月17日台立議字第1070703672號、107年05月09日台立議字第1070701070號、107年01月04日台立議字第1060705273號、107年10月17日台立議字第1070703671號函。
二、附審查報告乙份。
正本:議事處
副本:社會福利及衛生環境委員會
行政院函請審議「醫療器材管理法草案」、親民黨黨團擬具「醫療器材管理法草案」、委員黃秀芳等17人擬具「醫療器材管理法草案」、委員王育敏等16人擬具「醫療器材管理法草案」、委員劉建國等16人擬具「醫療器材管理法草案」、委員吳焜裕等25人擬具「醫療器材法草案」等6案併案審查報告
一、行政院函請審議「醫療器材管理法草案」、親民黨黨團擬具「醫療器材管理法草案」、委員黃秀芳等17人擬具「醫療器材管理法草案」、委員王育敏等16人擬具「醫療器材管理法草案」、委員劉建國等16人擬具「醫療器材管理法草案」、委員吳焜裕等25人擬具「醫療器材法草案」等6案,經分別提本院第9屆第4會期第15次會議、第6會期第4次會議、第3次會議、第5會期第10次會議、第4會期第14次會議、第6會期第3次會議報告後,均決定:「交社會福利及衛生環境委員會審查」。
二、本會於107年10月8日舉行第9屆第6會期第4次全體委員會議,進行行政院函請審議「醫療器材管理法草案」、委員劉建國等16人擬具「醫療器材管理法草案」、委員王育敏等16人擬具「醫療器材管理法草案」等3案之審查,會議由吳召集委員焜裕擔任主席,衛生福利部部長陳時中、醫事司司長石崇良、副司長廖崑富、法規會參事高宗賢、食品藥物管理署署長吳秀梅、中央健康保險署署長李伯璋、副署長蔡淑鈴、法務部參事劉英秀、財政部關務署簡任稽核楊美珍、國家通訊傳播委員會電台與內容事務處簡任視察林慧玲、經濟部工業局副局長楊志清、副組長王書龍、商業司專員陳若珊、智慧財產局著作權組科長陳怡靜等分別應邀列席說明、備詢。
三、本會復於107年10月24日及25日舉行第9屆第6會期第9次全體委員會議繼續進行審查,並將親民黨黨團擬具「醫療器材管理法草案」、委員黃秀芳等17人擬具「醫療器材管理法草案」、委員吳焜裕等25人擬具「醫療器材法草案」等3案併入審查,會議由吳召集委員焜裕擔任主席,衛生福利部部長陳時中、政務次長何啟功、醫事司副司長廖崑富、法規會參事高宗賢、食品藥物管理署署長吳秀梅、中央健康保險署專門委員黃育文、法務部參事劉英秀、財政部關務署副署長彭英偉、簡任稽核楊美珍、國家通訊傳播委員會電台與內容事務處簡任視察林慧玲、經濟部商業司專門委員胡美蓁、工業局科長林育諄、智慧財產局著作權組科長陳怡靜、國家發展委員會法制協調中心參事李世德、司法院民事廳法官蔡孟珊等機關代表分別應邀列席說明。
四、行政院之書面提案要旨:
我國現行對於醫療器材之管理係規範於藥事法,該法所稱「藥物」包括「藥品」及「醫療器材」。惟鑒於醫療器材係依產品風險程度採分類分級管理,與藥品管理不同,且近年醫療器材產業蓬勃發展,業者多元化經營模式與藥品業者頗具差異,故目前藥事法對藥物之規範尚難完足因應醫療器材之管理需求。
因應國際醫療器材管理法規快速變化趨勢,為使國內醫療器材管理制度更臻完善,衛生福利部自一百零三年起著手規劃醫療器材專法架構及法制面之評估,並參酌國際間有關醫療器材之管理規範,與我國國情進行調和,使醫療器材管理與國際接軌。一百零四年進行法規草擬,整合藥事法中醫療器材相關條文,研擬與國際調和及符合國內社會環境所需之規範,以健全國內醫療器材管理制度。
綜上,為依照醫療器材產品生命週期及風險管理原則,制定完善之醫療器材管理機制,以藥事法中醫療器材相關條文為基礎,收集並分析外國立法例,並兼顧國內醫療器材產業發展趨勢,建置符合我國實務管理之醫療器材專法,爰擬具「醫療器材管理法」(以下簡稱本法)草案,其要點如下:
(一)本法之立法目的、主管機關及用詞定義。(草案第一條至第十二條)
(二)完善醫療器材業者管理制度,規範醫療器材製造及販賣業者管理、產品流向建立、製造品質管理系統及運銷管理之規定。(草案第十三條至第二十四條)
(三)落實產品風險分級管理,規範製造或輸入醫療器材應辦理登錄或查驗登記;為保障消費者權益及使用產品安全,明確規範產品標示方式及刊載事項。(草案第二十五條至第三十三條)
(四)促進產業發展,規範輸出醫療器材得申請證明文件;因應公共衛生緊急狀況所需等情形,授權中央主管機關專案核准醫療器材之製造或輸入,以符合需求。(草案第三十四條至第三十六條)
(五)為保護受試者權益,規範醫療器材臨床試驗之管理,於臨床試驗施行期間或終止後發生與臨床試驗有關之不良情事,皆應通報。(草案第三十七條至第三十九條)
(六)基於消費者保護,規範醫療器材廣告申請資格、事前審查機制、傳播業者刊登規定、核准廣告效期及傳播方式限制之規定,健全廣告管理。(草案第四十條至第四十六條)
(七)為確保市售醫療器材之品質與安全,規範醫療器材商及醫事機構應配合執行安全監視、主動通報醫療器材嚴重不良事件、上市後再評估之規定,以利風險控管。(草案第四十七條至第五十條)
(八)主管機關得派員檢查醫療器材商或醫事機構之市售產品、邊境抽查輸入產品、醫療器材商普查之規定,受檢者不得規避、妨礙或拒絕。(草案第五十一條至第五十三條)
(九)為防止違法產品於市面上流通,規範查獲有重大危害人體健康之虞之醫療器材、非法醫療器材或不良醫療器材者,主管機關得採取之相關處分措施或限期回收處理之規定。(草案第五十四條至第五十九條)
(十)製造或輸入不良醫療器材、擅用或冒用醫療器材名稱、未經核准擅自製造或輸入醫療器材等違法行為之刑事處罰規定。(草案第六十條至第六十三條)
(十一)違反本法相關規定之行政處罰、異議及申請案件申復之規定。(草案第六十四條至第七十四條)
(十二)依本法辦理事項之相關費用、委任或委託之授權與認證及醫療器材創新科技研究發展之獎勵規定。(草案第七十五條至第八十條)
五、親民黨黨團之書面提案要旨:
有鑑於醫療器材為我國生醫發展極具潛力與優勢利基之項目,政府近年亦積極透過推動各項跨部會發展方案及精進管理法規機制,輔導產業快速發展。唯隨著生醫科技發展不斷推陳出新,醫療器材的功能領域已擴及至診斷、輔助、監測、預防到治療等,法規管理的範疇除須顧及臨床、產製、上市後管理等,並須隨科技的進展不斷革新。然而以我國目前的管理現況而言,醫療器材尚無專法規範,而是與藥品共同架構於藥事法之下,若以藥品的規則進行管理、規範臨床試驗做法,兩者屬性迥異、療效與安全評估模式殊異甚大的狀況下,往往造成醫材業者難以遵循、研發及上市受阻,因此,為調適我國醫材管理制度,提升管理效率,與國際趨勢接軌,優化產業法規環境,爰提出「醫療器材管理法草案」。
六、委員黃秀芳等17人之書面提案要旨:
鑑於我國現行醫療器材管理過去都集中由藥事法管理,然醫療器材是依產品風險程度採分類分級管理,與藥品管理方式不同,隨時代進步若持續歸於同一框架下管理,恐產生諸多問題,且近年醫療器材產業蓬勃發展,各種醫療器材不斷推陳出新,從出生嬰兒用的保溫箱、民眾常用的隱形眼鏡、受傷時貼的OK繃、老花眼鏡等,皆為隨處可見的醫療器材,業者多元化經營模式與藥品業者頗具差異,故目前藥事法對藥物之規範尚難完足因應醫療器材之管理需求。為因應國際醫療器材管理法規快速變化趨勢,考量新醫材與醫療技術發展之複雜性及多元化,需有明訂從研發到上市之管理法規,以改善醫療器材之現行管理模式,增進安全性與有效性。爰擬具「醫療器材管理法」,使國內醫療器材管理制度更臻完善,茲將詳細情形說明如下:
我國現行對於醫療器材之管理係規範於藥事法,該法所稱「藥物」包括「藥品」及「醫療器材」。惟鑒於醫療器材係依產品風險程度採分類分級管理,與藥品管理不同,且近年醫療器材產業蓬勃發展,業者多元化經營模式與藥品業者頗具差異,故目前藥事法對藥物之規範尚難完足因應醫療器材之管理需求。
依照醫療器材產品生命週期及風險管理原則,制定完善之醫療器材管理機制,以藥事法中醫療器材相關條文為基礎,收集並分析外國立法例,並兼顧國內醫療器材產業發展趨勢,建置符合我國實務管理之醫療器材專法,爰擬具「醫療器材管理法」(以下簡稱本法)草案,其要點如下:
(一)本法之立法目的、主管機關及用詞定義。(草案第一條至第十二條)
(二)完善醫療器材業者管理制度,規範醫療器材製造及販賣業者管理、產品流向建立、製造品質管理系統及運銷管理之規定。(草案第十三條至第二十四條)
(三)落實產品風險分級管理,規範製造或輸入醫療器材應辦理登錄或查驗登記;為保障消費者權益及使用產品安全,明確規範產品標示方式及刊載事項。(草案第二十五條至第三十三條)
(四)促進產業發展,規範輸出醫療器材得申請證明文件;因應公共衛生緊急狀況所需等情形,授權中央主管機關專案核准醫療器材之製造或輸入,以符合需求。(草案第三十四條至第三十六條)
(五)為保護受試者權益,規範醫療器材臨床試驗之管理,於臨床試驗施行期間或終止後發生與臨床試驗有關之不良情事,皆應通報。(草案第三十七條至第三十九條)
(六)基於消費者保護,規範醫療器材廣告申請資格、事前審查機制、傳播業者刊登規定、核准廣告效期及傳播方式限制之規定,健全廣告管理。(草案第四十條至第四十六條)
(七)為確保市售醫療器材之品質與安全,規範醫療器材商及醫事機構應配合執行安全監視、主動通報醫療器材嚴重不良事件、上市後再評估之規定,以利風險控管。(草案第四十七條至第五十條)
(八)主管機關得派員檢查醫療器材商或醫事機構之市售產品、邊境抽查輸入產品、醫療器材商普查之規定,受檢者不得規避、妨礙或拒絕。(草案第五十一條至第五十三條)
(九)為防止違法產品於市面上流通,規範查獲有重大危害人體健康之虞之醫療器材、非法醫療器材或不良醫療器材者,主管機關得採取之相關處分措施或限期回收處理之規定。(草案第五十四條至第五十九條)
(十)製造或輸入不良醫療器材、擅用或冒用醫療器材名稱、未經核准擅自製造或輸入醫療器材等違法行為之刑事處罰規定。(草案第六十條至第六十三條)
(十一)違反本法相關規定之行政處罰、異議及申請案件申復之規定。(草案第六十四條至第七十四條)
(十二)依本法辦理事項之相關費用、委任或委託之授權與認證及醫療器材創新科技研究發展之獎勵規定。(草案第七十五條至第八十條)
七、委員王育敏等16人之書面提案要旨:
有鑑於我國現行醫療器材之管理規定規範於藥事法中,然藥物與醫療器材兩者管理方式不同,若持續歸於同一框架下管理,將致諸多相關問題產生。考量新醫材與醫療技術發展之複雜性及多元化,需有明訂從研發到上市之管理法規,以改善醫療器材之現行管理模式,增進安全性與有效性。另鑒於醫療器材產業為特許產業,應鼓勵相關醫療器材製造業者,加入當地所屬相關醫療器材公會,以利相關管理。此外,為同時兼顧醫療器材產業發展,與國際相關規範接軌,爰擬具「醫療器材管理法草案」,針對醫療器材廣告之申請資格、事前審查機制、傳播業者刊登規定、核准廣告效期及傳播方式之限制,訂定符合現今國際潮流之專屬規定。茲將詳細情形說明如下:
我國現行對於醫療器材之管理係規範於藥事法,該法所稱「藥物」包括「藥品」及「醫療器材」。惟鑒於醫療器材係依產品風險程度採分類分級管理,與藥品管理不同,且近年醫療器材產業蓬勃發展,業者多元化經營模式與藥品業者頗具差異,故目前藥事法對藥物之規範尚難完足因應醫療器材之管理需求。
除了藥事法之外,民國93年行政院衛生署訂定醫療器材管理辦法,之後雖然經過多次修正,然而隨著醫療器材產業的迅速發展,僅以管理辦法的法律位階來規範醫療器材已經明顯不足,因此為了確實保障消費者之安全,以及促進醫療器材產業的發展,同時使管理制度臻於完善,故將訂定專法管理醫療器材。
綜上,為依照醫療器材產品生命週期及風險管理原則,制定完善之醫療器材管理機制,以藥事法中醫療器材相關條文為基礎,收集並分析外國立法例,並兼顧國內醫療器材產業發展趨勢,建置符合我國實務管理之醫療器材專法,爰擬具「醫療器材管理法」(以下簡稱本法)草案,其要點如下:
(一)本法之立法目的、主管機關及用詞定義。(草案第一條至第十二條)
(二)完善醫療器材業者管理制度,規範醫療器材製造及販賣業者管理、產品流向建立、製造品質管理系統及運銷管理之規定。(草案第十三條至第二十四條)
(三)落實產品風險分級管理,規範製造或輸入醫療器材應辦理登錄或查驗登記;為保障消費者權益及使用產品安全,明確規範產品標示方式及刊載事項。(草案第二十五條至第三十三條)
(四)促進產業發展,規範輸出醫療器材得申請證明文件;因應公共衛生緊急狀況所需等情形,授權中央主管機關專案核准醫療器材之製造或輸入,以符合需求。(草案第三十四條至第三十六條)
(五)為保護受試者權益,規範醫療器材臨床試驗之管理,於臨床試驗施行期間或終止後發生與臨床試驗有關之不良情事,皆應通報。(草案第三十七條至第三十九條)
(六)基於消費者保護,規範醫療器材廣告申請資格、事前審查機制、傳播業者刊登規定、核准廣告效期及傳播方式限制之規定,健全廣告管理。(草案第四十條至第四十六條)
(七)為確保市售醫療器材之品質與安全,規範醫療器材商及醫事機構應配合執行安全監視、主動通報醫療器材嚴重不良事件、上市後再評估之規定,以利風險控管。(草案第四十七條至第五十條)
(八)主管機關得派員檢查醫療器材商或醫事機構之市售產品、邊境抽查輸入產品、醫療器材商普查之規定,受檢者不得規避、妨礙或拒絕。(草案第五十一條至第五十三條)
(九)為防止違法產品於市面上流通,規範查獲有重大危害人體健康之虞之醫療器材、非法醫療器材或不良醫療器材者,主管機關得採取之相關處分措施或限期回收處理之規定。(草案第五十四條至第五十九條)
(十)製造或輸入不良醫療器材、擅用或冒用醫療器材名稱、未經核准擅自製造或輸入醫療器材等違法行為之刑事處罰規定。(草案第六十條至第六十三條)
(十一)違反本法相關規定之行政處罰、異議及申請案件申復之規定。(草案第六十四條至第七十四條)
(十二)依本法辦理事項之相關費用、委任或委託之授權與認證及醫療器材創新科技研究發展之獎勵規定。(草案第七十五條至第八十條)
八、委員劉建國說明提案要旨:
鑑於我國現行醫療器材管理規定,係規範於藥事法,該法所稱「藥物」,包括「藥品」及「醫療器材」,惟鑒於醫療器材係依產品風險程度採分類分級管理,與藥品管理不同,且近年國內醫療器材產業蓬勃發展,業者多元化經營模式與藥品業者頗具差異,故目前藥事法對藥物之規範尚難以足因應醫療器材之管理需求。為因應國際醫療器材管理法規快速變化趨勢,使國內醫療器材管理制度更臻完善,乃整合藥事法中醫療器材相關條文,並參酌衛生福利部105年11月15日公告之「醫療器材管理法」草案,並兼顧國內醫療器材產業發展趨勢,特擬具「醫療器材管理法草案」。茲將詳細情形說明如下:
本法制定完善之醫療器材管理機制,以藥事法中醫療器材相關條文為基礎,依照醫療器材產品生命週期及風險管理原則,並參酌衛生福利部105年11月15日公告之「醫療器材管理法」草案,並兼顧國內醫療器材產業發展趨勢,建置符合我國實務管理之醫療器材專法架構。本法共分九個章節,全文共八十七條,其要點如下:
(一)本法之立法目的、主管機關與用詞定義。(草案第一條至第十三條)
(二)完善醫療器材業者管理制度,規範醫療器材製造及販賣業者管理、產品流向建立、製造品質管理系統要求及運銷管理之規定。(草案第十四條至第二十六條)
(三)落實產品風險分級管理,規範製造或輸入醫療器材應辦理登錄或查驗登記;為保障消費者權益及使用產品安全,明確規範產品標示方式及事項。(草案第二十七條至第三十四條)
(四)促進產業發展,規範輸出醫療器材得申請證明文件,制定醫療器材科技研究發展之獎勵;因應公共衛生緊急狀況所需,授權中央主管機關專案核准醫療器材,以符合需求。(草案第三十五條至第三十九條)
(五)為保護受試者權益,規範醫療器材臨床試驗之管理,醫療器材臨床試驗施行期間發生與臨床試驗有關之不良情事,皆應通報(草案第四十條至第四十二條)
(六)基於消費者保護,規範醫療器材廣告申請資格、事前審查機制、傳播業者刊登規定、核准廣告效期及傳播方式限制之規定,健全廣告管理。(草案第四十三條至第四十九條)
(七)為確保市售醫療器材之品質與安全,規範醫療器材商及醫事機構應配合執行安全監視、主動通報因醫療器材引起之嚴重不良反應、上市後再評估之規定,以利風險控管。(草案第五十條至第五十三條)
(八)定明主管機關得派員檢查醫療器材商或醫事機構之市售產品、邊境抽查輸入產品、醫療器材商普查之規定,受檢者不得規避、妨礙或拒絕。(草案第五十四條至第五十六條)
(九)為防止違法產品於市面上流通,規範查獲有重大危害醫療器材、非法醫療器材或不良醫療器材者,主管機關對產品之處分措施或限期回收處理之規定。(草案第五十七條至第六十二條)
(十)定明製造或輸入不良醫療器材、擅用或冒用醫療器材名稱、未經核准擅自製造或輸入醫療器材等違法行為之刑事處罰規定。(草案第六十三條至第六十六條)
(十一)違反本法各項情節之行政處罰、異議或申請案件申復之規定。(草案第六十七條至第七十九條)
(十二)依本法辦理事項之相關費用、委任或委託之授權與認證及本法施行日期之規定。(草案第八十條至第八十七條)。
九、委員吳焜裕等25人之書面提案要旨:
鑑於醫療器材之使用直接涉及人民生命身體安全,為強化對於國民健康風險預防的掌握,自應制定獨立法規以加強管理,此外我國老年化社會之到來,各類醫療器材之使用越見頻繁,醫療器材之種類繁多,除須強調管制上之效率外,又醫療器材係依產品風險程度採分類分級管理,與藥品管理不同,且因應國際醫療器材管理法規快速變化趨勢,為使國內醫療器材管理制度更臻完善,應參酌國際間有關醫療器材之管理規範,落實風險分級的管理概念,以兼顧消費者安全及管制效率,綜上,為保障國人使用醫療器材之安全、增進國民健康、強化醫療器材管理及促進醫療器材產業之發展,特制定「醫療器材法」草案。茲將詳細情形說明如下:
我國現行對於醫療器材之管理係規範於藥事法,該法所稱「藥物」包括「藥品」及「醫療器材」。惟鑒於醫療器材係依產品風險程度採分類分級管理,與藥品管理不同,且近年醫療器材產業蓬勃發展,業者多元化經營模式與藥品業者頗具差異,故目前藥事法對藥物之規範尚難完足因應醫療器材之管理需求。
因應國際醫療器材管理法規快速變化趨勢,為使國內醫療器材管理制度更臻完善,應參酌國際間有關醫療器材之管理規範,與我國國情進行調和,使醫療器材管理與國際接軌,以健全國內醫療器材管理制度。
綜上,為依照醫療器材產品生命週期及風險管理原則,制定完善之醫療器材管理機制,以藥事法中醫療器材相關條文為基礎,參考外國立法例的管理方式,並兼顧國內醫療器材產業發展趨勢,建置符合我國實務管理之醫療器材專法,爰擬具「醫療器材法」(以下簡稱本法)草案,其要點如下:
(一)本法之立法目的、主管機關及用詞定義。(草案第一條至第十二條)
(二)完善醫療器材業者管理制度,規範醫療器材製造及販賣業者管理、產品流向建立、製造品質管理系統及運銷管理之規定。(草案第十三條至第二十四條)
(三)落實產品風險分級管理,規範製造或輸入醫療器材應辦理登錄或查驗登記;為保障消費者權益及使用產品安全,明確規範產品標示方式及刊載事項。(草案第二十五條至第三十四條)
(四)醫療器材發展日新月異,醫療器材的使用可能涉及個人醫療等極私密資訊之收集,自應特別允以保護,此外,個資收集之同意應配合科技載具之進步,增加類同書面同意以外之同意方式。(草案第三十二條)
(五)促進產業發展,規範輸出醫療器材得申請證明文件;因應公共衛生緊急狀況所需等情形,授權中央主管機關專案核准醫療器材之製造或輸入,以符合需求。(草案第三十五條至第三十六條)
(六)為保護受試者權益,規範醫療器材臨床試驗之管理,於臨床試驗施行期間或終止後發生與臨床試驗有關之不良情事,皆應通報;並為落實臨床試驗主體之管制,修正臨床試驗主體之認定。(草案第三十七條至第三十九條)
(七)基於消費者保護,規範醫療器材廣告申請資格、事前審查機制、醫療器材分級廣告制度、傳播業者刊登規定、核准廣告效期及傳播方式限制之規定,健全廣告管理。(草案第四十條至第四十七條)
(八)醫療器材的輸出入隨著國際貿易的推展越趨頻繁,為確保消費者使用產品的安全以及國內醫療器材的管制不因輸出入而有漏洞,醫療器材的輸出入管制宜以單獨章節規定(草案第四十八條至第五十條)
(九)為確保市售醫療器材之品質與安全,規範醫療器材商及醫事機構應配合執行安全監視、主動通報醫療器材嚴重不良事件、上市後再評估之規定,以利風險控管。(草案第五十一條至第五十四條)
(十)為防止違法產品於市面上流通,規範查獲有重大危害人體健康之虞之醫療器材、非法醫療器材或不良醫療器材者,主管機關得採取之相關處分措施或限期回收處理之規定;製造或輸入不良醫療器材、擅用或冒用醫療器材名稱、未經核准擅自製造或輸入醫療器材等違法行為之刑事處罰規定。(草案第五十五條至第六十二條)
(十一)為保障消費者之權益,爰參考國內相關基金制度及犯罪被害人保護法之精神,明定醫療器材使用者保護基金之設立及其運作(草案第六十三條至第六十四條。)
(十二)違反本法相關規定之行政處罰、異議及申請案件申復之規定。(草案第六十五條至第七十六條)
(十三)依本法辦理事項之相關費用、委任或委託之授權與認證及醫療器材創新科技研究發展之獎勵規定。(草案第八十條至第八十五條)
十、衛生福利部部長陳時中就行政院、各委員提案提出報告及說明:
(一)背景
鑒於醫療器材管理模式及產業特性與藥品不同,以「藥事法」管理醫療器材甚難完妥,且近年醫療器材產業蓬勃發展,所以將醫療器材之管理由現行「藥事法」抽離,單獨制定醫療器材專法,使醫療器材管理與國際接軌,並符合國內實務管理需要。
草案制定重點包括納入從事醫療器材設計業者可為許可證持有者;彈性核定許可證有效期間,加速產品上市;醫療器材維修業者列為醫療器材販賣業者;管理醫療器材販售及供應型態;建構醫療器材臨床試驗管理;建立醫療器材來源、流向及運銷品質管理;部分低風險之醫療器材改採登錄制度;強化上市後醫療器材安全監督管理;賦予廠商主動監控上市後產品安全之責任,完善醫療器材管理制度。
(二)「醫療器材管理法」草案,主要制定重點內容如下:
1.促進產業技術研發、產品創新及製造品質管理(草案第十條、第二十二條、第二十七條)
草案依醫療器材關鍵製程明確定義醫療器材製造業,以利產業遵循;納入從事醫療器材設計業者可為許可證持有者,提升產學研界研發高階醫療器材之意願,鼓勵產業研發及產品創新。未來針對新創醫療器材,可搭配上市後研究(post-approval study)或安全監視之期程彈性核定許可證有效期間,加速其上市以嘉惠病人。
2.完善醫療器材多元化科技產業管理(草案第十一條至第十八條)
因應醫療器材產業蓬勃發展,規範經營醫療器材租賃或維修者,納入醫療器材販賣業者管理。因應科技發展,產品販售型態多元,可公告限制特定醫療器材種類、品項之販售或供應型態。針對不同醫療器材產業類別,需僱用具專業學經歷並接受教育訓練之技術人員,以提升專業管理。
3.健全產品流向系統及運銷品質管理(草案第十九條、第二十四條)
明定醫療器材商及醫事機構,應建立及保存產品直接供應來源及流向之資料,以利上市後產品追蹤。推動醫療器材運銷品質管理,確保產品品質於運銷過程不致減損。
4.落實醫療器材風險分級管理(草案第二十五條至第二十九條)
部分低風險之醫療器材改採電子化線上登錄制度,簡化上市前申請程序,加速產品上市期程,並採年度申報方式延續登錄效力,使醫療器材之資訊得以及時更新。
5.建構醫療器材臨床試驗管理(草案第三十七條至第三十九條)
醫療器材臨床試驗相關規範獨立成章健全管理。明定執行經公告無顯著風險之醫療器材臨床試驗,毋須申請核准。發生與臨床試驗有關之不良事件時,應通報中央主管機關。中央主管機關認有安全之虞者,得命試驗之機構中止或終止試驗,或採取其他必要之措施,以確保研究參與者之安全。
6.強化上市後醫療器材安全監督管理(草案第四十七條至第四十九條)
強化現行醫療器材安全監督管理機制,除規範部分特定高風險醫療器材,於上市後指定期間內須進行安全監視外,明定醫事機構應予配合。亦督導廠商主動監控上市後產品風險管理,並進行相關矯正預防措施,保障消費者安全。
(三)修法各提案版本之綜合說明
各委員亦提出醫療器材管理法草案,謹就提案重大修正重點,簡要回應說明如下:
1.新增必要醫療器材之許可證持有者無法製造或輸入時之通報義務。
提案委員:劉建國等16人(委員提案新增第18條)
回應說明:
委員版本新增必要醫療器材之許可證持有者無法製造或輸入時之通報義務,立意良善,惟醫療器材產品係基於設計生產,鮮少有不可取代性,如經評估確有實需,建議酌予調整,並列入合適之條文章節。
2.定明醫療器材商應加入當地所屬相關醫療器材公會,始得營業。
提案委員:王育敏等16人(草案第13條)
回應說明:
依商業團體法第12條規定,依公司法或商業登記法取得登記證照之公營或民營商業之公司、行號,開業後即應加入當地商業同業公會為會員,其兼營二業以上商業者,除其他法律另有規定外,至少應選擇一業加入該業商業同業公會為會員。工業團體法第13條規定,同一區域內,經依法取得工廠登記證照之公營或民營工廠,除國防軍事工廠外,均應於開業後一個月內,加入工業同業公會為會員;其兼營兩種以上工業者,應分別加入各該業工業同業公會為會員。有關醫療器材商開業後須加入公會一案,建議循工業團體法及商業團體法相關規定辦理。
3.延長醫療器材廣告核准效期為三年。
提案委員:王育敏等16人(草案第43條)
回應說明:
委員提案建議延長醫療器材廣告核准效期為3年,本部敬表尊重,惟可能需考量後續管理之成本,酌予調整廣告審查規費。
(四)結語:
本醫療器材管理法草案,使醫療器材管理與國際接軌,提升我國醫療器材產業實力及國際競爭力,完善醫療器材管理制度。
十一、與會委員於聽取說明及詢答後,於第9次全體委員會議對法案進行逐條審查及縝密討論,經在場委員充分溝通交換意見後達成共識,將全案審查完竣。茲將審查結果臚列如下:
(一)照行政院提案通過:法案名稱、各章章名、第二條、第四條至第七條、第九條至第十二條、第十六條、第二十條至第二十九條、第三十一條、第三十二條、第三十六條、第三十九條至第四十二條、第四十四條至第四十六條、第四十八條、第五十一條至第五十四條、第五十六條、第五十七條、第五十九條至第六十三條、第六十五條至第六十七條、第六十九條、第七十條、第七十二條、第七十四條至第七十八條、第八十條、第八十一條至第八十三條(條次變更為第八十四條至第八十六條)。
(二)經參酌各委員之提案或修正動議,將行政院提案修正通過:
1.第一條,依委員吳焜裕等3人所提修正動議,修正為「為保障國人使用醫療器材之安全、效能及品質、增進國民健康及強化醫療器材管理,特制定本法。」
2.第三條,依委員吳焜裕等3人所提修正動議,將第二項修正為「前項醫療器材之分類、風險分級、品項、判定原則及其他相關事項之辦法,由中央主管機關定之。」
3.第八條,依委員吳焜裕等3人所提修正動議,將第二款修正為「二、依標籤或說明書刊載之用法,作正常合理使用時易生危險,或危害人體健康之虞。」;並增列第七款「七、經中央主管機關公告之其他瑕疵。」
4.第十三條:
(1)依委員吳焜裕(王榮璋)等4人所提修正動議,增列第四項「第二項申請醫療器材商,如非有公司登記或商業登記者,需檢附其目的事業主管機關同意函。」
(2)依委員王育敏(李彥秀)等5人所提修正動議,增列第五項「第二項之醫療器材商,應依工業團體法或商業團體法之規定加入同業公會。」
5.第十四條,依委員邱泰源等3人所提修正動議,增列第三項「醫事機構為執行業務之必要,得供應業務相關之醫療器材,並得免請領醫療器材販賣業許可執照。」
6.第十五條,依委員吳焜裕等3人所提修正動議,修正如下:
「醫療器材製造業者及從事輸入或維修之販賣業者,應視醫療器材類別,聘僱技術人員。
前項醫療器材類別、技術人員資格及比例、教育訓練之課程時數及其他相關事項之辦法,由中央主管機關定之。
醫療器材製造業者及從事輸入或維修之販賣業者依第一項聘僱之技術人員,因解聘、辭聘或其他原因不能執行其任務而未另行聘僱者,主管機關應令其限期改善,屆期未改善者,應即停止醫療器材之製造、輸入或維修業務。」
7.第十七條,依委員吳焜裕等3人所提修正動議,修正為「醫療器材商不得購入或承租未經查驗登記、登錄或非醫療器材商供應之醫療器材。」
8.第十八條,依委員陳宜民等3人所提修正動議,將首句修正為「中央主管機關應視醫療器材使用風險」。
9.第十九條,依委員邱泰源等3人所提修正動議:
(1)將第一項修正為「經中央主管機關公告一定風險等級之醫療器材,醫療器材商及醫事機構應建立與保存產品直接供應來源及流向之資料。」
(2)第三項條文之「保存方式、」後,增列「保存年限、」等字。
10.第三十條,依委員吳焜裕等3人所提修正動議,將第二項修正為「前項醫療器材之品項、規格、檢驗方法及性能,由中央主管機關公告之;未定檢驗方法者,得依國際間認可之方法為之;如未有國際間認可之檢驗方法者,應予以證實其合適性。」
11.第三十三條,依委員吳玉琴等3人修正動議,增列第三項「醫療器材除依第一項規定刊載外,有提供點字或其他足供資訊易讀之輔助措施必要者,由中央主管機關公告之。」
12.第三十四條,依委員黃秀芳(劉建國)等4人所提修正動議,增列第四項及第五項:
「醫療器材商持有經中央主管機關公告為必要醫療器材之許可證,如有無法繼續製造、輸入或不足供應該醫療器材之虞時,應至少於六個月前向中央主管機關通報;如因天災或其他不應歸責於醫療器材商之事由,而未及於前述期間內通報者,應於事件發生後三十日內向中央主管機關通報。
中央主管機關於接獲前項通報或得知必要醫療器材有不足供應之虞時,得登錄於公開網站。」
13.第三十五條:
(1)依委員吳焜裕(尤美女)等4人修正動議,將第一項第四款修正為「專供樣品或贈品之用,或個人自用。」
(2)依委員黃秀芳(劉建國)等4人所提修正動議,增列第六款「依前條第四項公告為必要醫療器材之許可證產品,有無法繼續製造、輸入或不足供應之情形。」
14.第三十七條,依委員黃秀芳(劉建國)等4人所提修正動議,第一項首句之「臨床試驗機構執行醫療器材臨床試驗」,修正為「臨床試驗機構或試驗委託者發起醫療器材臨床試驗」;並於第三項條文之「及其他應遵行事項之辦法」前,增列「、受試者同意書應記載內容」等字。
15.第三十八條,依委員陳曼麗等3人所提修正動議,第一項序文修正為「醫療器材臨床試驗之受試者,於臨床試驗施行期間發生下列情事之一者,臨床試驗機構及試驗委託者應通報中央主管機關:」;並將第一項第二款及第三款修正為:「二、危及生命。三、暫時或永久性失能。」
16.第四十三條,依委員吳玉琴等3人所提修正動議,修正為「醫療器材廣告核准文件有效期間為三年,自核發證明文件之日起算。期滿有繼續刊播之必要者,應於期滿前六個月內,申請原核准機關展延之;每次展延期間,不得超過三年。」
17.第四十七條,依委員邱泰源等3人所提修正動議,將第一項文末「醫事機構應提供相關安全監視資料予醫療器材商。」,修正為「醫事機構應協助提供相關安全監視資料予醫療器材商。」
18.第四十九條:
(1)第一項,依委員陳宜民等3人所提修正動議,修正為「醫療器材許可證所有人或登錄者發現醫療器材有危害人體健康之虞時,應即主動通報中央主管機關,並採取矯正預防措施。」
(2)第二項,依委員陳曼麗等3人所提修正動議,修正為「前項矯正預防措施,應包括訂定警訊內容、更換零配件、產品檢測、暫停使用、產品回收或其他必要措施,並以合理方式揭露之,供醫事機構、醫療器材商及使用者知悉。」
19.第五十條,依委員陳宜民等3人及委員黃秀芳(劉建國)等4人所提修正動議,修正為「醫療器材經核准製造、輸入或完成登錄者,於其製造、輸入許可證或登錄有效期間內,經中央主管機關重新評估認有安全或醫療效能疑慮者,得令醫療器材商限期改善,必要時得令其下架、回收、暫停製造、輸入、販賣;屆期未改善或安全疑慮重大者,得廢止其許可證或登錄。」
20.第五十五條,依委員黃秀芳(劉建國)等4人所提修正動議,第一項修正為「直轄市、縣(市)主管機關對疑為未經查驗登記、登錄之醫療器材或不良醫療器材,就未經查驗登記、登錄之醫療器材部分,應先行就地封存,並抽取樣品予以查核或檢驗後,再行處理;就不良醫療器材部分,得先行就地封存,並抽取樣品予以查核或檢驗後,再行處理。其已發生重大危害者,應於報請中央主管機關核准後,沒入銷燬之。」
21.第五十八條,第一項序文及第二項條文中之「醫療機構」,均修正為「醫事機構」。
22.第六十四條,依委員吳焜裕等3人所提修正動議,第一項文中「第五款」後,增列「、第七款」等字。
23.第六十八條,依委員吳焜裕等3人所提修正動議,第一項第一款修正為「一、違反第十七條規定,購入或承租未經查驗登記、登錄或非醫療器材商供應之醫療器材。」
24.第七十一條:
(1)第一項第二款修正為「違反第十五條第一項規定,未聘僱技術人員。」
(2)第一項第三款修正為「違反第十九條第一項、第二項規定,或違反依第十九條第三項所定辦法有關資料之範圍、建立或保存方式、保存年限、申報內容、方式之規定。」
25.第七十三條,依委員陳宜民等3人所提修正動議,第一項首句「依本法申請醫療器材查驗登記」,修正為「依本法申請執行醫療器材臨床試驗、醫療器材查驗登記」。
26.第七十九條,依委員吳玉琴等3人所提修正動議及委員吳焜裕等3人所提修正動議,修正如下:
「本法關於技術人員之教育訓練、醫療器材之查驗登記審查、證明文件之核發、臨床試驗審查及查核、廣告審查、嚴重不良事件通報、醫療器材商檢查或普查等事項,主管機關得委任所屬機關(構),或委託其他機關(構)或經認證之法人或團體辦理。
前項委任或委託事項,除教育訓練外,受託者應遵守利益迴避原則;其委託、認證、利益迴避及其他相關事項之辦法,由中央主管機關定之。
第一項認證工作得委任所屬機關(構)或委託其他機關(構)辦理;其委任、委託及其相關事項之辦法,由中央主管機關定之。」
(三)委員吳焜裕等25人提案之第三十二條及第六十四條,經再提修正動議後,修正通過如下:
1.第三十二條:條次變更為第八十一條,條文修正為「研究機構、醫事機構或醫療器材商,因醫療器材之使用特性,依據個人資料保護法第六條第一項第六款蒐集、處理或利用個人資訊者,中央主管機關得公告其他等同書面之同意方式。」
2.第六十四條:條次變更為第八十三條,條文修正為:
「中央主管機關為醫療器材最終使用之病患或消費者之權益,得設立醫療器材最終使用之病患或消費者保護基金,並得委任、委託相關機關(構)、法人或團體辦理。
前項基金之來源如下:
一、違反本法罰鍰之部分提撥。
二、依本法科處並繳納之罰金及沒收之現金或財物變賣之所得。
三、依行政罰法規定追繳之不當利得部分提撥。
四、基金孳息收入。
五、捐贈收入。
六、循預算程序之撥款。
七、其他有關收入。
第一項基金之用途如下:
一、補助因醫療器材受害事件依消費者保護法之規定,提起之消費訴訟相關費用。
二、補助經公告之特定醫療器材受害事件,有關受害事件原因之鑑定費用。
三、補助其他有關促進醫療器材安全及消費者訴訟協助相關費用。
中央主管機關應設置基金運用管理監督小組,由學者專家、消費者保護團體、社會公正人士組成,監督補助業務。
第三項基金之補助對象、申請資格、審查程序、補助基準、補助之廢止、前項基金運用管理監督小組之組成、運作及其他應遵行事項之辦法,由中央主管機關定之。
第一項基金之設立日期,由中央主管機關另定之。」
(四)委員吳焜裕等25人提案第六十三條,條次變更為第八十二條,另有委員吳焜裕等3人所提修正動議1案,保留,送黨團協商。
(五)不予採納:委員劉建國等16人提案之第十八條(業已併入行政院提案第三十四條及第三十五條)、第十九條、第二十四條、第三十五條、第三十六條及第七十三條;委員吳焜裕等25人提案之第四十四條、第五十條及第六章章名。
(六)增列或修正行政院提案說明欄之立法說明:
1.第六條:修正第一點。
2.第十三條:增列第四點及第五點。
3.第十四條:增列第三點。
4.第四十二條:增列第一點,原第一點及第二點遞移。
5.第四十八條:增訂第三點。
6.修正第六十三條。
7.第六十六條:增列第一點,原第一點及第二點遞移。
8.第六十八條:增列第三點。
(七)通過附帶決議3項:
1.醫療器材管理法將過去尚未納管之醫療器材租賃業務一併納入管理,以此完備整體機制。然對於現行已提供爬梯機、電動輪椅等分屬於醫療器材之生活輔助工具租賃服務的非營利組織而言,基於過去主管機關並未將「租賃業務」納管,以致民間團體也不熟悉既有醫療器材相關管理規範,故實需主管機關協助。
爰此,要求衛生福利部於本法公告後一年內,積極針對現行已從事醫療器材管理法所涵蓋業務之非營利組織進行相關輔導,以協助其對於法規與行政管理流程之理解與遵循。
提案人:吳玉琴 陳曼麗 吳焜裕
2.醫療器材管理法源自藥事法條文,欲訂定專法,係為確保醫療器材管理機制建立之獨立性與完整性。醫療器材原分級標準亦應藉此立法討論過程中,重新檢視過去管理機制,爰要求衛生福利部應於六個月內針對醫療器材之分級標準、醫療器材應進行臨床人體試驗之標準等既有規範進行檢視,以提升後續新法公告施行後之業務效益。
提案人:吳玉琴 陳曼麗 吳焜裕
3.有鑑於我國邁入高齡化社會,對於醫療器材的需求將逐漸增加,為有效管理、追蹤醫療器材的安全及品質,並聽取相關專業人士之意見,爰要求本法於三讀通過施行後,衛生福利部應於相關子法制訂前,邀集專家學者、適用本法之全國性醫事機構團體(例如:中華民國藥師公會全國聯合會、社團法人中華民國醫事檢驗師公會全國聯合會、中華民國醫師公會全國聯合會……等)、輔具販賣租賃團體、消費者代表、各縣市主管機關代表,會同長期照顧司、社會及家庭署開會聽取意見,俾使法規周延,並維護民眾健康。
提案人:蔣萬安 吳玉琴 陳曼麗 王育敏 李彥秀
十二、爰經決議:
(一)併案擬具審查報告,提報院會討論。
(二)本案於院會進行二讀前,須交黨團協商。
(三)院會討論本案時,由吳召集委員焜裕補充說明。
十三、檢附條文對照表乙份。