立法院第10屆第6會期社會福利及衛生環境委員會舉行「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」公聽會會議紀錄
時 間 中華民國111年12月21日(星期三)9時1分至12時25分
地 點 本院群賢樓801會議室
主 席 張委員育美
主席:現在開會。
今天本會舉辦「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」公聽會,謝謝各位學者專家以及各政府機關代表蒞臨。公聽會探討的議題為「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」,國內疫情雖然呈現緩和的趨勢,但是經歷3年的防疫,不論是疫苗政策抑或是各項防疫規劃,以及疫情中與後疫情時代的醫療量能規劃,都有相當多值得檢討改善或精進之處。例如疫情嚴峻之時,許多醫療院所反映防疫物資不足,行政部門物資撥放延遲、數量缺乏,或者是撥放程序僵化、欠缺彈性。此外,事到今日依然有許多醫療院所與醫護人員指出,衛福部積欠獎勵津貼。不僅如此,面對特別預算期滿,明年度的預算編列是否到位、足不足以支持後疫情時代COVID-19的照護,也是醫療人員關心的課題。
我們要提醒行政部門,建構敏捷韌性醫療照護體系是新世代醫療網絡的核心理念,而為達到這樣的目標,投入充足的經費是首要前提,即時撥放給醫療人員應得的獎勵津貼是對醫療人員最基本的尊重。
今天公聽會探討的議題以提綱為準,請自行參閱。
接下來請衛福部薛部長報告,時間10分鐘。
薛部長瑞元:主席、各位委員女士、先生及各位來賓。今天貴委員會召開「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」公聽會,衛生福利部接受邀請列席參與,深感榮幸。針對COVID-19防疫作為之回顧與檢討提出說明如下:
嚴重特殊傳染性肺炎防治及紓困振興特別條例第七條訂定時,考慮疫情難以預測,有必要賦予指揮中心指揮官視疫情狀況,即時採取適切之應變處置作為,因此訂定第七條並由立法院三讀通過後,經總統公布,為民眾所得預見。而違法受處分者得藉由行政爭訟之司法途徑救濟。如果遇有重大爭議事件,監察院得依監察法啟動調查程序。立法院亦得透過質詢,要求行政機關對特定事件提供資料並回應詢答,以及透過預算審查程序監督並制衡行政機關。防疫首重時機,特別條例第七條賦予指揮中心指揮官針對疫情變化即時採行最有效、適當之防疫措施,符合功能最適理論,現行機制下仍有立法、司法及監察機關依法行使監督制衡權限,故與權力分立原則亦係相符。
本部辦理COVID-19疫苗等緊急採購,主要是依照政府採購法第一百零五條第一項第二款規定「人民之生命、身體、健康、財產遭遇緊急危難,需緊急處置之採購事項」而為之。至於如何本諸採購資訊公開及透明,使採購合法性得受公評與及時有效監督,考量疫苗採購合約各廠商契約之應保密期間長短不同,契約保密年限屆滿後即可對外公布合約內容。另,疫苗到貨數量則透過新聞稿方式即時供民眾知悉,疫苗使用情形每天公布於本部疾病管制署網頁提供外界參考,讓資訊得以公開透明,且之前國內外COVID-19疫苗採購合約,已配合立法院疫苗採購調閱專案小組,除個人資訊及廠商要求保密事項外,於110年11月1日至12月31日提供調閱。本部於遵守法規及契約保密義務之前提下,持續盡最大努力公開採購資訊。
為因應COVID-19疫情,加速我國新冠肺炎疫苗研發,政府全力投入相關資源協助國內廠商。本部提供研發廠商法規諮詢及技術輔導,並於關鍵製程派員駐廠監製,對COVID-19疫苗申請案亦採取滾動式審查機制,加速審查時效。本部綜合考量國際法規趨勢與國內疫情環境,經專家會議共同討論,訂定「我國對COVID-19疫苗EUA審查及療效評估基準」,作為廠商研發之參考依據。另考量疫情爆發未知性及國際疫苗研發產製與分配之不確定性,由政府補助國內疫苗研發確有其必要性,同時厚植國內疫苗研發生產能力。本部辦理109到110年度補(捐)助民間團體辦理研發COVID-19疫苗計畫,補助國內廠商執行COVID-19疫苗開發,並以完成臨床試驗第一期與第二期臨床試驗計畫為補助審核依據,共計補助國光生技與高端疫苗及聯亞生技三家廠商9.11億元,研發成果達到政府資源有效使用之最大化。
為加速預防接種受害救濟申請案件之鑑定,本部已擴增人力代為辦理病歷調閱,並將審議小組委員及專家依據醫學專科分組,密集召開分組會議,同步鑑定不同症狀類型之案件,再提報審議小組會議依法審定。另陸續加邀18位各領域之醫學專家,共同分擔鑑定審議工作。
依法核准製造或輸入之疫苗應繳納徵收金,經緊急授權使用之疫苗也可以申請受害救濟,其申請程序及審議制度一體適用。審議小組依法以公正審慎客觀之鑑定審議程序逐案檢視資料並提會討論審定。截至111年10月24日止,COVID-19疫苗已完成審議案件共計1,495件,核予救濟給付及補助金額計新臺幣1億0,519萬4,000元。預防接種受害救濟基金有調整徵收金機制,目前還沒有收支嚴重失衡情形發生。
因應國內COVID-19疫情防治需求,本部依法徵用國內廠商產製之醫用∕外科N95口罩、隔離衣、防護衣等防疫物資;實施口罩實名制,透過藥局、超商通路及網路預購等多元販售管道,提供民眾便利之口罩購買方式;定期撥配防疫物資予地方政府及中央機關,並由地方政府衛生局撥發轄區內醫療機構與公務機關作為醫療及防疫使用。依照疫情狀況及醫院防疫物資耗用情形不定期撥補,維持儲備量,維護醫護、防疫人員及民眾健康。
建立治療藥物採購機制,依臨床試驗研究實證,參考國際建議及諮詢專家意見,將各類抗病毒藥物納入「新型冠狀病毒感染臨床處置指引」之建議藥物,及時申請通過國內緊急使用授權。我國口服抗病毒藥物總採購量達212.7萬人份,以提供藥物適用對象預防或治療使用。為提升臨床醫師開立口服抗病毒藥物意願及便利性,與簡化領藥程序,擴增藥物配賦點及存放點。截至111年12月12日,口服抗病毒藥物合約機構共有2,903家,確定病例藥物使用比率為11.4%,僅次於美國,高於日本、香港、韓國、英國等,目前儲備量能實屬充裕。
此外,為簡化醫事機構獎勵及相關工作人員津貼申請作業,縮短撥款時程,本部透過比對相關資訊系統資料,持續優化申請作業,並降低人工錯誤,使獎勵費用及津貼發放更快速,直到111年12月14日止,醫事人員及社工人員取消出國補助、醫事機構獎勵及相關工作人員津貼,已經撥付了451億9,046萬8,973元。
以上報告,敬請各位參考。謝謝。
主席:謝謝部長。本次會議,部會及學者、專家所提供之相關書面資料,均列入紀錄,刊登公報。
衛生福利部書面意見:
主席、各位委員女士、先生:
今天 大院第10屆第6會期會期社會福利及衛生環境委員會召開「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」公聽會,衛生福利部承邀列席報告,深感榮幸。謹就討論提綱所列,說明如下:
討論提綱一、嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條所定「防治控制疫情需要」、「必要之應變處置或措施」是否有違法律明確性原則?本諸權力分立,監督與制衡機制之設計與界限為何?
一、嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條之背景及比例原則:
(一)按法律明確性之要求,如法律規定之意義,自立法目的與法體系整體關聯性觀點非難以理解,且個案事實是否屬於法律所欲規範之對象,為一般受規範者所得預見,並可經由司法審查加以認定及判斷者,即無違反法律明確性原則(司法院大法官釋字第432號、第690號解釋參照)。
(二)回顧嚴重特殊傳染性肺炎防治及紓困振興特別條例(下稱本條例)訂定時,國外疫情來勢洶洶且疫情變化不可測,對該疾病所知十分有限,難以明確釐定後續有效防治具體作為為何,又考量防治控制疫情須視疫情狀況即時採取適切之應變處置作為,有必要賦予中央流行疫情指揮中心指揮官相關彈性權限,爰訂定本條例第7條,且自本條文義可知,所謂必要之應變處置與措施,係以「為防治控制疫情之目的」為限,以「一般處分」將應遵守事項公告,其文義並非難以理解,且為一般民眾所得預見,受規制者亦得藉由行政爭訟之司法途徑救濟,尚符合法律明確性原則。
(三)相關防疫措施固具防止疫情蔓延之重要公益目的,惟仍須兼顧人民權益之保障,故本次防疫期間實際適用順序上,以傳染病防治法既有具體規定者優先適用;各部會亦可經由修正權責法規以符合防治需要;若傳染病防治法或其他法規未明確規定時,再視疫情急迫性及措施所需強度適用本條例第7條,以符合比例原則。
二、嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條本諸權力分立,監督與制衡機制之設計與界線為何?
(一)本條例第1條規定,以有效防治嚴重特殊傳染性肺炎,維護人民健康為其立法目的。考量嚴重特殊傳染性肺炎為新興傳染病,除發展難以預測外,一旦爆發,影響層面複雜且廣泛,為杜絕該疫情之蔓延,使其迅速獲得控制,即時及有效地保護人民生命安全及身體健康,本條例第7條授權中央流行疫情指揮中心指揮官專業判斷之空間,於傳染病防治法或其他法規未有明確規定時,仍得基於傳染病防治之專業,針對疫情變化,掌握先機採行最有效、適當之防疫措施,符合功能最適理論及權力分立原則。
(二)其次,本條例為限時法律,係依據立法程序由行政院提案,經立法院三讀通過後總統公布,訂定程序符合憲法第58條第2項及中央法規標準法第4條規定,其延長亦須依照本條例第19條第2項規定,經立法院同意延長之,符合民主立法正當性。
(三)再者,本條例施行期間,如有主管機關依據本條例對民眾個案違規行為依法裁處行政裁罰,受處分者如有不服,得依據訴願法及行政訴訟法規定,提起訴願或行政訴訟,由司法權審查個案裁罰之合法性,依法解決紛爭。
(四)如有重大爭議事件,監察院得依監察法啟動調查程序,對嚴重特殊傳染性肺炎中央流行疫情指揮中心(下稱指揮中心)、相關事件主管機關為函詢或約詢;立法院亦得透過質詢,要求行政機關對特定事件提供資料並回應詢答,亦得透過預算審查程序監督並制衡行政機關。
(五)綜上所述,本條例第7條係因應疫情變化不可測,賦予指揮中心指揮官相關彈性權限,以針對疫情變化即時採行最有效、適當之防疫措施,符合功能最適理論外,現行機制下仍有立法、司法及監察機關依法行使監督制衡之權限,故與權力分立原則亦係相符。
討論提綱二、COVID-19疫苗採購程序檢討:現行法制如何因應緊急採購?如何本諸採購資訊公開及透明,使採購合法性得受公評與及時有效監督?
一、現行法制如何因應緊急採購?
(一)依行政院公共工程委員會109年2月5日「因應武漢肺炎疫情,政府採購法有緊急採購機制」新聞稿內容略以:「……一、機關辦理緊急採購,可依採購法第22條(遇有不可預見之緊急事故,致無法以公開招標方式辦理,且確有必要者),或第105條(人民之生命、身體、健康、財產遭遇緊急危難,需緊急處置之採購),經機關首長或授權人員核准,無需公告招標,以爭取時效。二、對於涉及人民生命、身體、健康、財產遭遇緊急危難需緊急處置之採購,可依工程會訂定之「特別採購招標決標處理辦法」及「機關依政府採購法第105條第1項第2款辦理緊急採購作業範例」辦理。另各機關因應武漢肺炎,辦理緊急採購,為縮短採購作業,儘速取得防疫物資,除自行辦理採購外,亦可採數個機關合併集中採購,並可搭配複數決標,由多家廠商供應,分批交貨,俾及時防治疫情」。
(二)衛生福利部(下稱本部)辦理COVID-19疫苗採購,主要係依政府採購法第105條第1項第2款:「人民之生命、身體、健康、財產遭遇緊急危難,需緊急處置之採購事項」為之。
二、如何本諸採購資訊公開及透明,使採購合法性得受公評與及時有效監督?
(一)依政府資訊公開法第18條第1項第7款規定略以,政府資訊屬於個人、法人或團體營業上秘密或經營事業有關之資訊,其公開或提供有侵害該個人、法人或團體之權利、競爭地位或其他正當利益者,應限制公開或不予提供。COVID-19疫苗採購合約保密事項為營業秘密,為政府資訊公開法第18條第1項第7款不予提供之範圍。
(二)但,疫苗採購合約各廠商契約之應保密期間長短不同,契約保密年限屆滿後,即可對外公布合約內容;且除合約保密事項外,本部所採購疫苗到貨數量均透過新聞稿方式即時供民眾知悉,疫苗使用情形亦每日公佈於本部疾病管制署(下稱疾管署)網頁提供外界參考。
(三)另不論國內外COVID-19疫苗採購合約,均已配合立法院社會福利及衛生環境委員會10-4會期COVID-19疫苗採購調閱專案小組,除個人資訊及廠商要求保密事項外,於110年11月1日至12月31日提供調閱。
(四)綜上,COVID-19疫苗採購合約係政府代表國家與疫苗廠商簽署採購協議,故本應遵守與廠商約定的保密條款,尊重合作關係人隱私,避免影響後續合作關係及供貨期程,以致減損公共利益;惟本部仍將於遵守法規及契約保密義務之前提下,持續盡最大努力公開採購資訊,使其得受全民公評及監督,以達採購資訊公開及透明之效果。
討論提綱三、培植國產疫苗產業發展過程,國人健康把關、政府預算使用合理性等應有分際?
一、扶植國產疫苗研發,為國人健康把關:
(一)為加速我國COVID-19疫苗研發上市,本部全力投入相關資源協助國產疫苗研發,本部食品藥物管理署(以下簡稱食藥署)與財團法人醫藥品查驗中心透過組成專案諮詢輔導團隊,提供研發廠商及時的法規諮詢及技術輔導,並於關鍵製程派員駐廠監製,確保疫苗品質符合法規要求。另,食藥署對於COVID-19疫苗專案製造或輸入申請案,亦採取滾動式審查機制(rolling review),以加速審查時效。
(二)食藥署綜合考量國際法規趨勢與國內疫情環境,經專家會議共同討論,權衡COVID-19疫情的威脅風險與疫苗療效評估的法規科學理論基礎,訂定「我國對COVID-19疫苗EUA審查及療效評估基準」,作為廠商研發的參考依據。
二、政府預算使用合理性:
(一)因應全球 COVID-19疫情對公共衛生的衝擊,各國及製藥大廠皆致力研發藥品(含疫苗),尋求防治之道。考量疫情爆發未知性及國際疫苗研發產製與分配的不確定性,由政府補助國內疫苗研發確有其必要性,為保障國內屆時需求,同時厚植國內疫苗研發生產能力,降低國內廠商研發疫苗之風險,疾管署於109年7月23日公告辦理「109-110年度補(捐)助民間團體辦理研發COVID-19疫苗計畫」,補助國內廠商執行COVID-19疫苗開發,並以完成臨床試驗第一期與第二期臨床試驗計畫作為補助審核依據,分別補助國光生技1.22億元、高端疫苗4.6億元、聯亞生技3.29億元,總計補助9.11億元。
(二)透過各項積極輔導及補助措施,食藥署業於109年8月核准國光公司、高端公司及聯亞公司執行第一期臨床試驗,於109年12月及110年1月分別核准高端公司及聯亞公司執行第二期臨床試驗,另於110年7月30日核准高端新冠肺炎疫苗之專案製造。COVID-19疫苗研發補助計畫亦明定接受補助廠商應承諾上市後的原料藥或製劑之生產製造,承諾委託臺灣PIC/S GMP廠代工或自行設置PIC/S GMP廠生產製造,藉以提升國內藥物製造產業能量,並增加就業機會。
討論提綱四、預防接種受害救濟基金徵收及審議辦法之法制與執行檢討:有無修正必要?如何加速救濟審議進度?如何健全補償機制,維護民眾對於疫苗及政府之信心?及緊急使用授權(Emergency Use Authorization, EUA)疫苗之救濟經費來源與救濟標準之再思考。
一、現行預防接種受害救濟制度可提供保障:
依據傳染病防治法第30條第1項規定,因預防接種而受害者,皆得請求救濟補償,又依據同法第3項規定,疫苗檢驗合格時,皆應繳納徵收金充作預防接種受害救濟基金。是以只要依法核准製造或輸入之疫苗,於主管機關核發疫苗檢驗合格證明、檢驗或書面審查報告書時,皆屬應繳納徵收金之疫苗。緊急授權使用之疫苗,亦可申請預防接種受害救濟,其申請程序及審議制度一體適用,與其他常規疫苗保障相同,未有區別。
二、預防接種受害救濟制度仍需有專業客觀的判斷機制:
目前就預防接種受害救濟之關聯性判斷,主係參酌世界衛生組織於2018年更新之「預防接種不良事件因果關係評估準則」,該準則一體適用於各種疫苗之因果關係評估。為減少民眾對於鑑定審議結果之疑慮,縱使申請案件量驟增,審議小組仍依法以公正、審慎、客觀之鑑定審議程序,逐案檢視病歷及醫學實證等資料,經提會討論而作出審定,該審定結果並經書面合法送達,民眾如不服審定結果,可依法定程序提起訴願救濟,落實預防接種受害救濟精神。
三、COVID-19疫苗受害救濟案件已結案者計1,495案,救濟給付最高金額達600萬元:
(一)經預防接種受害救濟審議小組(下稱審議小組)審議,認預防接種與受害情形為「相關」者,自可依法核予救濟金,而對於關聯性判定為「無法確定」者,依預防接種受害救濟基金徵收及審議辦法(下稱審議辦法)第18條第1項附表規定,亦可獲得救濟補償,已屬制度上的從寬處理;審議小組審酌個案救濟金時,也會以疑似受害人有利之立場,從寬審定其救濟給付金額。
(二)截至111年11月24日止,本部總計受理COVID-19疫苗受害救濟案件計7,042案,目前已結案者計1,495案。經審議小組審定為「相關」及「無法確定」而核予救濟金者計165案;無關但核予醫療補助、喪葬補助或胚胎補助者計148案。已完成審議案件共核予救濟給付及補助金額計新臺幣1億519萬4,000元。核予救濟給付之案件中,4件判為「相關」之死亡案件,經審議小組審定核予法定最高救濟給付金額600萬元。
四、因應預防接種受害救濟案件大量增加,為加速審議進度,及維護民眾權益,本部已採行以下因應作為:
(一)自110年10月下旬起由本部委辦單位社團法人國家生技醫療產業策進會擴增人力代為辦理病歷調閱工作及處理相關行政工作,以減少疫情期間地方人力不足所造成之病歷調閱進度延宕。
(二)目前預防接種受害救濟審議程序修正方案,已將審議小組委員及專家依據其醫學專科分為5個工作分組,密集召開分組會議同步鑑定不同症狀類型之案件,以加速處理時效。申請案件經各工作分組討論並決定關聯性及救濟金額後,提報審議小組會議依法審定。後續將視案件審議狀況,增加邀請醫學專家協助鑑定審議。
(三)考量疑似疫苗不良反應之症狀類型,已陸續加邀病理解剖、心臟內科、血液疾病、胸腔內科、婦產科等領域之18位醫學專家,共同分擔審議小組委員之鑑定審議工作。
五、緊急使用授權疫苗之救濟經費仍得由預防接種受害救濟基金支應:
(一)如前述,目前緊急授權使用之疫苗亦依傳染病防治法第30條第3項規定繳納徵收金,而預防接種受害救濟基金如遇預算短絀以致基金收支嚴重失衡,將依審議辦法第3條規定,先檢討調整每疫苗人劑之徵收金額,如需由公庫投入挹注,將依附屬單位預算執行要點政事基金第26點,報行政院專案核定,挹注基金財源,俾利保障民眾獲得救濟之權益。
(二)目前預防接種受害救濟基金尚未有收支嚴重失衡之情形,日後如預防接種受害救濟基金總額低於1億5,000萬元時,本部將依審議辦法第3條規定檢討適度調整徵收金額,維持基金財務健全,以達成預防接種受害救濟制度行政目的。
討論提綱五、疫情期間醫療量能調度配置之檢討:防疫物資之撥發【如個人防護裝備(Personal Protective Equipment, PPE)、抗病毒藥物、清冠一號等】如何達到及時、近便要求,以維護醫療人員與民眾健康權益?防疫獎勵、補助與津貼發放,如何簡政便民、從優從速回應醫療人員與機構期待?
一、個人防護裝備之徵用/採購及提供如何達到及時、近便要求,以維護醫療人員與民眾健康權益?
(一)因應國內COVID-19疫情防治需求,本部依指揮中心指示依法徵用國內廠商產製之一般醫用/外科/N95口罩/隔離衣/防護衣,以及採購乳膠手套及防護面罩等個人防護裝備,以因應民生、醫療及公務防疫需求。
(二)在民生需求部分,於109年2月6日實施口罩實名制,透過健保特約藥局與衛生所通路販售口罩。之後為解決部分上班族與學生沒有時間排隊購買口罩的問題,以及提升民眾多元購買管道便利性,分別自109年3月12日及4月22日起實施口罩實名制2.0及3.0,開放民眾透過網路預購、於超商事務機預購口罩,至超商取貨,滿足民眾購買口罩之需求。
(三)至於醫療及公務防疫部分,則定期撥予地方政府及中央機關,並請地方政府衛生局撥發轄區公務機關及醫療院所使用,另視地方疫情狀況,增加撥補頻率與數量,並請地方政府衛生局盤點轄區醫療與公務機關使用及需求情形,倘有需求可再提出申請。此外醫院部分,除上開衛生局撥配個人防護裝備外,持續監測智慧防疫物資管理系統(SMIS)醫院外科口罩、N95口罩、隔離衣耗用量,並視疫情狀況及依醫療院所任務別不定期撥補維持儲備量;基層診所部分,依執業登記醫師人數撥發西醫/中醫/牙醫診所一般醫用/外科口罩供醫師及工作人員使用並調整數量,以及定期撥發N95口罩及隔離衣供儲備運用,以維護醫護、防疫人員及民眾健康。
二、COVID-19口服抗病毒藥物之採購儲備及提供如何達到及時、近便要求,以維護民眾健康權益?
(一)指揮中心因應COVID-19防疫之需,為強化醫療應變量能,防範境外移入之病毒變異株感染個案導致之社區傳播風險,建立抗病毒藥物採購機制,密切定期關注藥物療效及安全性大型隨機臨床試驗研究實證,參考國際建議並諮詢專家,自109年起陸續將瑞德西韋(Remdesivir)、口服藥(Paxlovid、Molnupiravir)及單株抗體(Evusheld)等抗病毒藥物納入「新型冠狀病毒(SARS-CoV-2)感染臨床處置指引」建議藥物,建立抗病毒藥物預採購機制,及時申請通過國內緊急使用授權,以提供藥物適用對象預防或治療使用。指揮中心仍將持續蒐集國際之COVID-19相關預防及治療策略與藥物資訊,並視疫情需要評估擴充儲備。
(二)為提升臨床醫師開立口服抗病毒藥物意願及便利性,以增加COVID-19確定病例口服抗病毒藥物用藥率、降低重症及死亡風險,維護民眾健康權益,指揮中心簡化領藥流程,並擴增藥物配賦點(各地方政府衛生局、醫院及核心藥局)及存放點(接受衛生局或核心藥局等配賦點調撥藥物存放的單位)。截至111年12月12日,口服抗病毒藥物合約機構有醫院326家、基層診所1,228家、藥局1,121家、衛生局22家、衛生所206家等,共2,903家。
(三)就各國COVID-19口服抗病毒藥物儲備及投藥率觀之,截至111年12月12日,我國總採購量為212.7萬人份;COVID-19口服抗病毒藥物累計使用97萬8,646人份,確定個案使用口服抗病毒藥物用藥比率為11.4%,全球排名超前,僅次於美國12.24%,較日本3.73%、香港6.55%、韓國1.33%、英國0.34%為高。與上述國家疫情嚴重相較,我國投藥率仍超越該些國家,若以10%投藥率估計,於發生千萬名以上確診個案時仍足供因應需用藥者需求。整體而言,我國COVID-19抗病毒藥物之採購、到貨進度與用藥比率都優於其他國家,爰COVID-19抗病毒藥物採購儲備量能實屬充裕。
三、防疫獎勵、補助與津貼發放,如何簡政便民、從優從速回應醫療人員與機構期待?
(一)為慰勉醫事機構及從業人員(包含醫事人員、社工人員、清潔人員及行政人員)於疫情期間之辛勞,本部依據嚴重特殊傳染性肺炎防治及紓困振興特別條例第2條規定,訂定「執行嚴重特殊傳染性肺炎醫療照護及防治發給補助津貼及獎勵要點」,辦理醫事人員及社工人員取消出國補助、醫事機構獎勵及相關工作人員津貼。
(二)為簡化醫事機構獎勵及相關工作人員津貼申請作業,縮短撥款時程,本部持續精進相關行政程序,說明如下:
1.自109年7月起,本部透過醫院於醫事司緊急醫療管理系統通報收治COVID-19疑似或確診病例資料,勾稽疾管署傳染病個案通報系統及健保署健保申報資料或健保卡上傳資料,由本部計算各項獎勵費用後,直接進行撥款。並請醫院於收款後一周內,應完成院內人員分配及撥款作業。
2.醫事人員津貼由醫院依收治COVID-19疑似或確診病例個案數,計算所需人員津貼後,向本部提出申請;因審查、補件及撥款程序繁瑣,自110年4月起,持續調整申請方式:
(1)109年4月起,以醫院申請金額八成進行預付,於審核後撥付剩餘款。
(2)為使醫院申請時程一致,避免公文補件往返,本部110年底建置津貼及獎勵金申請系統,自111年5月起,以醫院通報緊急醫療管理系統通報收治COVID-19疑似或確診病例人日數,計算人員津貼後,每月10日前預付,前一個月預估津貼金額予醫院,並請醫院一週內完成人員分配及撥款,並於一個月內至津貼及獎勵金申請系統完成申請,本部審核後核撥剩餘款,提升第一線醫療照護人員領取津貼時效。
(三)依據上開申請及撥款程序,本部截至111年12月14日止,醫事人員及社工人員取消出國補助、醫事機構獎勵及相關工作人員津貼已撥付451億9,046萬8,973元,包含:
1.醫事人員及社工人員取消出國補助:補助期間為109年2月23日至同年6月30日,共補助8,732人,金額計新臺幣(下同)8,922萬9元。
2.醫事機構獎勵:已撥付267億6,692萬2,964元,包含:
(1)完成設置專責病房、專責加護病房、採檢站、檢驗實驗室、無障礙空間優化等獎勵費用計15億1,673萬3千元。
(2)每月專責病房與專責加護病房基礎及收治獎勵、採檢案件及個案獎勵、治療獎勵、重症患者照護獎勵、個案轉檢獎勵、陽性個案轉檢與採檢獎勵、海外遠距健康諮詢獎勵、救護車轉送陽性個案獎勵,以及急救責任醫院防疫獎勵等費用計124億6,662萬4,362元。
(3)109年及110年全國醫院、診所及衛生所等年度防疫績效獎勵費用計127億2,959萬元。
(4)110年度醫療機構感染重建與支援津貼及獎勵費用(部桃專案):5,397萬5,602元。
3.相關工作人員津貼:已撥付183億3,432萬6,000元,包含:
(1)111年1月至11月申請醫院家數計269家,撥款金額計109億2,553萬2,000元。
(2)110年申請醫院家數計194家,全額撥付187家及預撥計7家醫院,撥款金額計46億3,884萬4,000元。
(3)109年醫事人員津貼已全數撥付,計27億6,995萬元。
(四)為使防疫相關獎勵費用及相關人員津貼發放更快速、簡化並加速撥款,本部透過比對相關資訊系統資料,持續優化申請作業,並降低人工錯誤,使相關費用發放貼近臨床實際照護情形;而為落實資訊公開原則,本部亦每週公布撥款資訊於本部網站之嚴重特殊傳染性肺炎專區。(網址:https://covid19.mohw.gov.tw/ch/mp-205.html)
外交部書面意見:
立法院第10屆第6會期
社會福利及衛生環境委員會公聽會
外交部報告資料
一、自2019年底全球COVID-19疫情爆發,中央流行疫情指揮中心(CECC)於2020年1月底成立迄今,本部持續配合CECC相關防疫政策,並透過捐贈防疫物資及經驗分享等方式,協助友邦及友好國家強化因應疫情之能量,傳達「Taiwan Can Help」之聲音,為全球對抗疫情做出貢獻。
二、本次公聽會議程討論提綱有關疫苗部分,本部曾協助辦理捐贈及受贈疫苗相關工作,相關情形如下:
(一)我國受贈疫苗:美、日、歐等理念相近國家於疫情期間向我充分展現民主夥伴間之真摯情誼。我國自上(2021)年6月起迄今受贈逾900萬劑疫苗,包括美國兩度捐贈我莫德納疫苗共計400萬劑;日本自上年6月至10月六度對我捐贈逾420萬劑AZ疫苗,係對我最大疫苗捐贈國;另歐洲如波蘭(40萬劑AZ)、立陶宛(近26萬劑AZ)、斯洛伐克(16萬劑AZ)及捷克(3萬劑莫德納)也捐贈我近85萬劑疫苗。在全球各國共同合作對抗疫情蔓延之際,美國、日本、立陶宛、斯洛伐克、捷克、波蘭等國馳援捐贈我國疫苗,有效提升我疫苗接種覆蓋率。
(二)我國援贈疫苗:為共同因應疫情威脅,並以實際行動協助友好國家防疫,在索馬利蘭政府正式核准我國產高端疫苗緊急使用授權(EUA)後,我政府於上年12月宣布援贈15萬劑高端疫苗予索國。另,我國嗣於本(2022)年3月捐贈加勒比海友邦聖露西亞及聖文森各1萬劑AZ疫苗,以具體行動展現民主自由夥伴間之相互扶持。索國、露國及聖國政府均對我國政府協助其等對抗疫情表示肯定及感謝。
(三)我國援贈其他防疫物資:自疫情爆發以來迄今,我國已捐贈各國重要防疫物資如醫用口罩、國產核酸儀、額溫槍、額溫測量系統、熱像體溫顯示儀、隔離防護衣、製氧機及血氧機等,均獲各國政要公開對我致謝。
三、目前全球疫情趨緩,各國陸續恢復社會及經濟活動,本部將持續配合CECC協助推動辦理防疫相關業務,共同守護國人健康。
數位發展部書面意見:
依中央流行疫情指揮中心110年5月29日公布施行之「COVID-19防疫新生活運動:實聯制措施指引」,各機關對於實聯制蒐集之個人資料僅可保存28天,屆期即應主動將個人資料予以刪除或銷毀,並應留存執行刪除或銷毀之項目及日期等軌跡紀錄。
依前揭指引,機關為蒐集、處理及利用個人資料,得以紙本或電子方式為之,皆應善盡資料安全維護義務,採行適當之技術上及組織上安全措施,並指定專人辦理安全維護事項,防止個人資料被竊取、竄改、毀損、滅失或洩漏。機關以資訊系統或APP實施實聯制者,應進行資訊安全風險評估,採行相符安全控制措施,確保系統安全防護水準。
依個人資料保護法第5條「個人資料之蒐集、處理或利用,應尊重當事人之權益,依誠實及信用方法為之,不得逾越特定目的之必要範圍,並應與蒐集之目的具有正當合理之關聯。」復依該法第11條第3項「個人資料蒐集之特定目的消失或期限屆滿時,應主動或依當事人之請求,刪除、停止處理或利用該個人資料。」
爰依法行使公權力之中央或地方機關應依個人資料保護法及實聯制措施指引規定,落實執行上開個人資料保護措施,以兼顧民眾資訊隱私權之保障。
內政部移民署書面意見:
主席、各位委員、先進,大家好:
首先,感謝各位委員及專家學者對於嚴重特殊傳染性肺炎(COVID-19)防疫作為的重視與關心,以下針對疫情前後入出境人次統計及本署配合中央流行疫情指揮中心(下稱指揮中心)之境管防疫作為部分進行報告,敬請各位委員及專家學者惠予指導。
壹、疫情前後入出境人次統計
(一)疫情前入出境人次統計表 (單位:人次)
|
|
入境
|
出境
|
|
國人
|
外來人口
|
合計
|
國人
|
外來人口
|
合計
|
|
106
|
15,476,239
|
10,598,073
|
26,074,312
|
15,504,412
|
10,541,237
|
26,045,649
|
|
107
|
16,106,377
|
9,982,503
|
26,088,880
|
16,245,289
|
9,975,367
|
26,220,656
|
|
|
16,915,287
|
8,240,572
|
25,155,859
|
17,034,535
|
8,275,147
|
25,309,682
|
(二)疫情後入出境人次統計表 (單位:人次)
|
|
入境
|
出境
|
|
國人
|
外來人口
|
合計
|
國人
|
外來人口
|
合計
|
|
109
|
2,602,125
|
1,365,869
|
3,967,994
|
2,363,900
|
1,553,656
|
3,917,556
|
|
110
|
334,707
|
130,093
|
464,800
|
359,686
|
167,549
|
527,235
|
|
|
1,164,319
|
568,602
|
1,560,259
|
1,088,792
|
386,707
|
1,475,499
|
※謹註:111年相關數據統計至111年12月14日
貳、本署配合指揮中心之境管防疫作為
(一)配合邊境管制政策,機動調整配套:持續配合指揮中心邊境管制政策,即時調整各項境管措施,並同步修正「開放各類人士來臺一覽表」,方便民眾查詢最新境管規定。
(二)落實整備查驗設施,視況調派人力:因應邊境防疫措施放寬,整備各機場及港口查驗設施,確保軟硬體運作順暢;密切監控國境人流,視旅運量機動調派勤務人力;每日根據旅客尖、離峰時段,調控查驗櫃檯開設數量及加強動線引導;向國人宣導多加使用自動查驗通關。
(三)勤前宣達防疫措施,強化清消感控:透過勤前教育對內宣達最新防疫及邊境管制措施,同時依據防疫計畫及通報機制,強化防疫警覺及落實風險控管,並持續落實清消程序及做好感控措施,以確保旅客通關順暢及邊境安全與穩定。
參、疫情期間相關防疫作為及執行成效
(一)執行特殊大型包機查驗專案:配合指揮中心執行滯留海外國人包機返臺專案,共計查驗2,420人。
(二)提供重要防疫決策數據:自109年1月起,持續提供各項入出境人數及在臺外來人口統計資料,作為各類決策及追蹤管理重要參考資訊;協助跨機關建置防疫相關資訊系統,包含衛生福利部(下稱衛福部)「入境檢疫系統」及「居家檢疫追蹤系統」與衛福部健康保險署「健保雲端旅遊史查詢系統」等。
(三)落實國境人流管制:審查入境旅客旅遊史、核酸檢驗報告及入境資格,不符規定者執行拒入及遣返事宜,自109年1月23日至111年10月13日,共計拒入986人;另協助衛福部疾病管制署針對未滿居家檢疫期間者禁止出境事宜,自109年1月23日至111年10月13日,計查獲禁止出境對象78人。
(四)配合執行落地採檢勤務:配合長程及東南亞航班落地採檢措施,自111年1月11日至111年5月31日共計查驗6,267人;針對有症狀旅客之後送及採檢事宜,開設查驗專檯,減少有症狀旅客與其他旅客接觸機會。
(五)配合防疫政策,推動專案解決問題:
為減少人流移動,降低國內感染風險,陸續實施下列相關應變措施:
1.逐月自動延長在臺合法停留之外來人口停留期限:逐月自動延長109年3月21日前在臺合法停留之外來人口停留期限,共計延長42萬79人次(外國人計25萬1410人次、大陸地區人民計12萬5,694人次、香港澳門居民計2萬8,137人次、臺灣地區無戶籍國民計1萬4,838人次)。
2.協處大陸地區人民及港澳居民專案申請來臺:疫情期間以「急迫性、必要性、不可替代性」為審核原則,協處中港澳人士有緊急或人道考量者專案簽報指揮中心許可來臺,截至111年12月14日止,本署共計協處2,184人以專案方式入臺,其中大陸地區人民社會交流案598人;大陸地區人民專業交流案270人、商務活動交流案779人;香港及澳門居民緊急協處案537人。
肆、結語
本署全面配合指揮中心防疫政策,落實人流控管,確保通關順暢及境線安全與穩定,以兼顧服務、防疫與安全。
以上報告,懇請委員及專家學者惠予指教,並敬祝身體健康!萬事如意!謝謝!
法務部書面意見:
主席、各位委員、各位女士、先生:
今天奉邀列席 貴委員會召開「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」公聽會,本部謹就討論提綱所列涉及本部業務主管事項,說明如下:
【討論提綱一】嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條所定「防治控制疫情需要」、「必要之應變處置或措施」是否有違法律明確性原則?本諸權力分立,監督與制衡機制之設計與界線為何?
一、依司法院釋字第690號解釋理由書所示:「……法律明確性之要求,非僅指法律文義具體詳盡之體例而言,立法者於立法定制時,仍得衡酌法律所規範生活事實之複雜性及適用於個案之妥當性,從立法上適當運用不確定法律概念而為相應之規定。如法律規定之意義,自立法目的與法體系整體關聯性觀點非難以理解,且個案事實是否屬於法律所欲規範之對象,為一般受規範者所得預見,並可經由司法審查加以認定及判斷者,即無違反法律明確性原則(本院釋字第432號、第521號、第594號及第602號解釋參照)。又依釋字第734號解釋理由書指出「……授權是否具體明確,應就該授權法律整體所表現之關聯意義為判斷,非拘泥於特定法條之文字……」。
有關嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條條文中使用「防治控制疫情需要」、「必要之應變處置或措施」等規範,應係立法者基於最適切功能,於國家在面對Covid-19疫情突然發生、快速蔓延全國各地造成多人受感染死亡或重大傷害之情況下,為杜絕疫情之蔓延,使疫情迅速獲得控制,降低社會之恐懼不安等重大公共利益,授權由行政機關針對瞬息萬變之疫情狀況,隨機應變,迅速有效採取必要之措施以控制疫情。是以,倘法律規定之意義,自法條文義、立法目的與法體系整體關聯性觀點觀察,非難以理解,且個案事實是否屬於法律所欲規範之對象,為受規範者所得預見,並可經由司法審查加以認定及判斷者,即難謂違反法律明確原則。
二、另依釋字第613號解釋理由書所載:「作為憲法基本原則之一之權力分立原則,其意義……在於權力之區分,將所有國家事務分配由組織、制度與功能等各方面均較適當之國家機關擔當履行,以使國家決定更能有效達到正確之境地,……。惟權力之相互制衡仍有其界限,除不能牴觸憲法明文規定外,亦不能侵犯各該憲法機關之權力核心領域,或對其他憲法機關權力之行使造成實質妨礙或導致責任政治遭受破壞,例如……剝奪憲法所賦予其他國家機關之核心任務;或逕行取而代之,而使機關彼此間權力關係失衡等等情形是。」而立法院行使憲法所賦予之立法職權,並享有一定之調查權,藉此發揮權力分立與制衡之機能(釋字第585號解釋文參照)。
又行政救濟制度亦為監督與制衡機制之一環,查衛生福利部歷次公告各級疫情警戒標準及防疫措施裁罰規定,多係依據傳染病防治法第36條、第37條第1項第1款、第2款、第6款及相對應之罰則規定;並於公告內容敘明不服該處分者得提起訴願之救濟教示,故處分相對人如認處分有違法致損害其權利或法律上利益者,可循行政爭訟途徑救濟之。
以上報告,敬請 主席及各位委員指教,謝謝。
審計部書面意見:
主席、各位委員女士、先生:
今日應邀列席貴委員會召開之「嚴重特殊傳染性肺炎(COVID-19)防疫作為之回顧與檢討」公聽會,深感榮幸。茲就政府防治預算執行及本部審核情形,簡要報告如下:
一、政府防治預算執行情形
政府為因應嚴重特殊傳染性肺炎(下稱COVID-19)疫情,編列中央政府嚴重特殊傳染性肺炎防治及紓困振興特別預算(下稱嚴重特殊傳染性肺炎特別預算),執行期間自109年1月15日至112年6月30日,預算規模為8,393億餘元,其中有關防治作業部分,截至111年11月底止,由衛生福利部(下稱衛福部)等9個主管機關編列預算2,122億907萬餘元,已全數分配,主要辦理疫苗採購與接種、邊境管制、居家隔離檢疫、醫療量能調度整備及防疫物資儲備等相關作業,執行結果,累計實現數1,658億7,651萬餘元,占預算數之78.16%,主要係衛福部治療藥物與醫療器材調度、補助地方政府防疫動員、防疫物資徵用、採購及運送、防治人員津貼、病患隔離治療等經費尚待核銷所致。
二、本部審核情形
COVID-19防治經費規模龐鉅,各項因應措施之執行成效攸關民眾身體健康,亦為各界關注焦點,爰本部自109年下半年起,即持續針對政府各項防疫作為進行查核並提出建議意見,以協助政府提升防疫效能。以下謹就今日公聽會討論題綱,說明本部審核情形:
(一)嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條所定「防治控制疫情需要」、「必要之應變處置或措施」是否有違法律明確性原則?本諸權力分立,監督與制衡機制之設計與界線為何?
中央流行疫情指揮中心為防杜COVID-19疫情入侵與傳播,依嚴重特殊傳染性肺炎防治及紓困振興特別條例第7條規定,於疫情期間實施必要之應變處置或措施,係屬其行政權責。本部則針對行政機關所訂定之各項防疫措施,檢視其落實情形及執行成效,發揮監督之功能。
(二)COVID-19疫苗採購程序檢討:現行法制如何因應緊急採購?如何本諸採購資訊公開及透明,使採購合法性得受公評與及時有效監督?
疫苗採購經行政院公共工程委員會函釋,適用政府採購法,且衛福部考量倘涉及商業機密,應負保密義務,得認定符合機密採購。依據政府採購法第105條第1項第2款(緊急採購)及特別採購招標決標處理辦法第5條規定略以,應先確認人民之生命、身體、健康或財產遭遇緊急危難,且核准確有緊急處置之必要,核准文件應記載招、決標規定中因緊急處置得不適用之條文,未記載者,仍應適用該法。本部查核發現,疫苗受限於全球供需及賣方市場情形下,此次疫苗採購契約條文與採購契約範本規範有別,且未敘明不適用之條文,為完備法制規範,允宜研議適切辦理方式,或於傳染病防治法增訂緊急採購相關規範,以建立合宜採購程序與機制,使採購合法性得受公評;另衛福部應研議於不違反採購契約保密條款下,適時公開疫苗採購執行情形,以增進採購資訊公開及透明。
(三)培植國產疫苗產業發展過程,國人健康把關、政府預算使用合理性等應有分際?
有關我國疫苗發展及預防接種政策推動情形,本部查核發現,近年來疫苗基金迭有短絀,影響新疫苗導入及接種時程,衛生福利部傳染病防治諮詢會預防接種組(ACIP)建議於108至112年間推動之5項疫苗導入方案,均囿於基金財源不足,暫緩實施。另財團法人國家衛生研究院報告指出,我國對於預防接種之投入經費及疫苗自製比率均較先進國家為低,且COVID-19疫情後,雖曾與國外疫苗廠商洽談代工製造疫苗,惟因產能無法達到國外廠商要求而未能成案,疫苗研發及產製能量均待提升。允宜妥為擘劃疫苗產業發展策略,輔導國內疫苗廠商強化研發產製能量,俾提升自有疫苗供應能力及國家競爭力。
(四)預防接種受害救濟基金徵收及審議辦法之法制與執行檢討:有無修正必要?如何加速救濟審議進度?如何健全補償機制,維護民眾對於疫苗及政府之信心?及緊急使用授權(Emergency Use Authorization,EUA)疫苗之救濟經費來源與救濟標準之再思考。
依傳染病防治法第30條第1項規定,因預防接種而受害者,得請求救濟補償。本部查核發現,110年因擴大施打COVID-19疫苗,疫苗接種受害救濟申請案件數大幅增加,截至同年10月底止,與COVID-19疫苗相關之申請案件計1,588件,其中僅22件完成審議,占申請案量之1.39%,各界迭有審議進度緩慢,影響民眾權益之訾議。允宜檢討案件審理時效,儘速完成審議作業,使預防接種受害民眾迅速獲得合理之補償。經本部追蹤結果,衛福部已自110年10月底起委託社團法人國家生技醫療產業策進會代地方政府辦理病歷調閱及相關行政作業,並增加審議小組人力與開會頻率,截至111年10月底止,申請案件6,885件,完成審議1,275件,占比約18.52%。
(五)疫情期間醫療量能調度配置之檢討:防疫物資之撥發【如個人防護裝備(Personal Protective Equipment ,PPE)、抗病毒藥物、清冠一號等】如何達到及時、近便要求,以維護醫療人員與民眾健康權益?防疫獎勵、補助與津貼發放,如何簡政便民、從優從速回應醫療人員與機構期待?全民健康保險財務長年收支失衡,全民健康保險法第26條所定「調整保險給付範圍方案」可得扮演之角色與作用?
有關醫療量能調度及防疫物資儲備方面,本部查核發現:口服抗病毒藥物未適用藥害救濟制度,倘民眾使用後產生不良反應,無法獲得救濟補償;慰勉醫事機構及人員津貼及獎勵未及時核撥,又部分醫院未儘速將獲撥款項撥付與分配予相關人員等情事。允宜檢討研謀改善,以提升防疫作業效能。
有關健保收支失衡方面,依全民健康保險法第26條第1款規定,保險安全準備低於1個月之保險給付,由中央健康保險署擬訂調整保險給付範圍方案。截至111年11月底止,保險安全準備餘額尚有約1.34個月保險給付。又中央健康保險署係依「全民健康保險醫療費用申報與核付及醫療服務審查辦法」審查醫療費用,該署因應疫情已放寬醫療費用之審查作業。本部查核發現,健保保險收支成長受人口結構改變影響,支出高於收入之結構性失衡問題尚難改善。允宜適時推動支付制度改革,督促醫療院所減少非必要之醫療處置,以減緩醫療費用之成長幅度。
三、結語
本部已針對政府各項防疫作業執行成效,辦理相關查核作業,審核結果已分別函請行政院及衛福部研謀妥處,並獲具體因應改善措施。相關重要審核意見已擇要納列110年度中央政府總決算審核報告第1冊乙篇壹、「政府因應嚴重特殊傳染性肺炎防治及紓困振興相關計畫執行情形」專章、第2冊丙篇拾玖、衛福部主管重要審核意見等章節,本部當賡續注意其執行情形與效益。
以上報告,謹請
主席、各位委員女士、先生指教,謝謝!
蘇明通顧問書面意見:
111年12月21日
主席、各位委員、各位先進,大家好!
承蒙大院邀請出席本次公聽會,至感榮幸!
以下謹就討論提綱第二議題COVID-19疫苗採購程序檢討,提供意見:
一、現行法制如何因應緊急採購
政府採購法(下稱採購法)在因應緊急採購方面,已有對應之規定:
(一)依採購法第22條第1項第3款規定,機關辦理公告金額(目前為新臺幣100萬元)以上之採購,如遇有不可預見之緊急事故,致無法以公開或選擇性招標程序適時辦理,且確有必要者,得採限制性招標。也就是說,得不經公告程序,邀請二家以上廠商比價或僅邀請一家廠商議價。
(二)依採購法第105條第1項第2款規定,當人民之生命、身體、健康遭遇緊急危難,需緊急處置之採購事項,得不適用本法招標、決標之規定。同條第二項則授權主管機關行政院公共工程委員會(下稱工程會)另定處理辦法予以規範。工程會已訂定「特別採購招標決標處理辦法」,臚列作業程序規定,包括此等採購需先簽報機關首長或其授權人員核准確有緊急處置之必要,以及在核准文件記載到底那些招標及決標的規定,因為緊急處置之採購需要而不適用,但也不是所有條文都可以不適用。例如,發現投標廠商提供不實文件時,仍然要依照採購法第50條第1項之規定不予決標。為協助各機關正確作業,工程會還訂頒「機關依政府採購法第105條第1項第2款辦理緊急採購作業範例」,供各機關參考。
(三)109年初,國外爆發新冠疫情後,工程會即於109年1月30日工程企字第1090100098號函通知各機關,如需緊急辦理與2019新型冠狀病毒肺炎有關之各項採購,採購法第22條第1項第3款及第105條第1項第2款已有緊急採購機制,請各機關視個案情形依規定儘速妥處,並再於同年2月5日發布相同內容之新聞稿,週知各界。
(四)上述採購法的緊急採購機制,符合世界貿易組織(WTO)政府採購協定第3條(得免適用協定的特別除外事項,包括維護人類生命或健康之必要措施)、第13條(得採不公告招標程序的限制性招標之情形)之規定,與國際接軌。
二、如何本諸採購資訊公開及透明,使採購合法性得受公評與及時有效監督
在採購資訊公開及透明方面,未經公告招標程序辦理之限制性招標,其決標公告仍適用採購法第61條刊登決標公告之規定,亦即除有特殊情形者外,應於決標後一定期間內,將決標結果之公告刊登於政府採購公報(同時也會公開於政府電子採購網)。其施行細則第84條對於刊登決標公告之一定期間,明定為自決標日起30日;對於可以不必刊登政府採購公報之特殊情形,則明定4款情形,包括:
(一)為商業性轉售或用於製造產品、提供服務以供轉售目的所為之採購,其決標內容涉及商業機密,經機關首長或其授權人員核准者。
(二)有本法第一百零四條第一項第二款(軍事機密採購)情形者。
(三)前二款以外之機密採購。
(四)其他經主管機關認定者。
因此,如果COVID-19疫苗採購案係屬前述第3款機密採購,依照採購法第61條及其施行細則第84條規定,保密期間即免刊登決標公告,但在解密後,仍可補登決標公告。關於機密等級之認定與核定權責,國家機密保護法已有規定;屬於機密者,中央部會首長即可核定。至於保密期間的長短,如果疫苗廠商無要求,採購機關可視實際需要合理訂定。
另一方面,疫苗廠商基於銷售策略及商業利益考量,亦有可能堅持將保密條款作為報價簽約條件,採購機關為了取得急需之疫苗,也只能接受。至於保密期間之長短,有賴買賣雙方協商,此時採購機關可儘量爭取較短之保密期間。
當保密期間有其必要,或不得不接受廠商堅持之保密條款時,如果能儘量將保密期間縮短,以利儘早解密公開,將可使採購合法性儘早接受公評與監督。
不過,即使在保密期間,大院依照立法院職權行使法,仍可行使調閱權;採購法第108條規定之採購稽核小組,包括衛生福利部、工程會各自成立之採購稽核小組,仍可稽核監督採購事宜;審計機關依採購法第109條規定,亦得隨時稽察;主管機關、上級機關及主計機關依採購法第100條規定,得隨時查核各機關採購進度、存貨或其使用狀況,亦得命其提出報告。
上述不公開決標資訊之措施,符合世界貿易組織政府採購協定第3條(得免適用協定的特別除外事項,包括維護人類生命或健康之必要措施)、第17條不揭露資訊的特別規定(包括可能損害廠商間公平競爭、影響特定人之合法商業利益、保護智慧財產權、違反公共利益等)。
以上意見,敬請指教,並祝大家
新年及聖誕快樂,萬事如意。謝謝!
金傳春兼任教授書面意見:
顏鴻順常務理事書面意見:
蔡震榮系主任書面意見:
邱淑媞教授書面意見:
林欣柔副教授書面意見:
陳仕津先生書面意見:
翁伊吟律師書面意見:
陳宜民理事長書面意見:
王任賢理事長書面意見:
主席:在與會人員發言前,主席先作以下宣告:學者、專家及本院委員每位發言時間6分鐘,為簡報方便,學者、專家發言,請至主席臺右邊的發言臺發言。原則上由學者、專家依簽到順序先行發言,委員如要發言,請到主席臺登記。
全部人員發言結束後,再請行政機關作整體回應;暫定10時30分休息10分鐘。因為今天薛部長10時30分要到財政委員會備詢,所以會先離開,但離開前,也請薛部長先行回應前面專家、學者的發言。
首先請宏道法律事務所蘇明通顧問發言。
蘇明通顧問:主席、各位委員、各位先進大家好!承蒙大院邀請本人出席本次公聽會,至感榮幸。以下謹就討論提綱第二項議題:COVID-19疫苗採購程序的檢討,提供意見。
一、現行法制如何因應緊急採購
採購法在因應緊急採購方面,已有對應之規定:
依採購法第二十二條第一項第三款規定,機關辦理公告金額(目前為新臺幣100萬元)以上之採購,如遇有不可預見之緊急事故,致無法以公開或選擇性招標程序適時辦理,且確有必要者,得採限制性招標。也就是說,得不經公告程序,邀請二家以上廠商比價或僅邀請一家廠商議價。
依採購法第一百零五條第一項第二款規定,當人民之生命、身體、健康遭遇緊急危難,需緊急處置之採購事項,得不適用本法招標、決標之規定。例如,當採行不公告招標的限制性招標的條件時,可以不受採購法第二十二條既有條件的限制;如果在比價或議價時,有需要超底價決標,超底價決標的百分比也可以不受採購法第五十三條規定的8%限制。
另外,第一百零五條第二項則授權主管機關工程會另訂處理辦法予以規範。工程會已訂定「特別採購招標決標處理辦法」,臚列作業程序規定,包括此等採購需先簽報機關首長或其授權人員核准確有緊急處置之必要,以及在核准文件記載到底哪些招標及決標的規定,因為緊急處置之採購需要而不適用,所以如果沒有記載不適用條文,原有招標、決標條文規定還是都要適用。但所謂不適用,也不是所有招標、決標規定條文都不適用,在工程會的辦法裡有特別明定哪些條文還是要適用,例如當我們發現廠商投標文件有不實時,仍然要依照採購法第五十條第一項規定不予決標。另外為協助各機關正確作業,工程會還訂頒相關作業範例供各機關參考。
109年初國外爆發新冠疫情之後,工程會即於109年1月30日通函各機關,如需緊急辦理與2019新冠肺炎有關之各項採購,採購法第二十二條第一項第三款及第一百零五條第一項第二款已有緊急採購機制,請各機關視個案情形依規定儘速妥處。同年2月5日再發布相同內容之新聞稿周知各界。
上述緊急採購機制符合世界貿易組織(WTO)政府採購協定第三條及第十三條規定,其中,第三條係特別除外事項,包括維護人類生命或健康之必要措施;第十三條則是不公告限制招標情形,所以國內的採購法規是與國際接軌的。
其次,如何本諸採購資訊公開及透明,使採購合法性得受公評與及時有效監督?如果是未經公告招標程序辦理之限制性招標,其決標公告仍然要依照採購法第六十一條規定,刊登決標公告,惟特殊情形者可以不必刊登。至於所謂一定期間,目前規定是決標日期三十天;而可以不必刊登採購公告之特殊情形,採購法施行細則第八十四條訂有四款情形:一、為商業性轉售目的所為之採購,其決標內容涉及商業機密,經機關首長或其授權人員核准者。二、軍事機密採購。三、其他二款以外之機密採購。四、其他經主管機關認定者。
因此,COVID-19疫苗採購,如係機密採購,則依照採購法第六十一條與施行細則第八十四條規定,於保密期間免刊登決標公告,但解密之後還是可以補登決標公告。至於機密等級之核定,在國家機密保護法中已經有規定。
另外,疫苗廠商基於銷售策略與商業利益考量,也有可能堅持將保密條款作為報價簽約的條件,採購機關為了取得急需的疫苗也只能接受。至於保密期間長短,有賴買賣雙方協商。此時採購機關可儘量爭取較短的保密期間,當保密期間有其必要或不得不接受廠商堅持之保密條款時,如果能儘量將保密期間縮短,以利儘早解密公開,將可使採購合法性儘早接受公評與監督。
不過,即使在保密期間,大院依照立法院職權行使法,仍可行使調閱權;採購法第一百零八條規定之採購稽核小組,包括衛生福利部、工程會各自成立之採購稽核小組,仍可稽核監督採購事宜;審計機關依採購法第一百零九條規定,亦得隨時稽察;主管機關、上級機關及主計機關依採購法第一百條規定,得隨時查核各機關採購進度、存貨或其使用狀況,亦得命其提出報告。
上述不公開決標資訊之措施,符合世界貿易組織政府採購協定第三條及第十七條不揭露資訊之特別規定。
以上意見,敬請指教,並祝大家新年及聖誕快樂。謝謝!
主席:請臺大公衛學院流病所金傳春兼任教授發言。
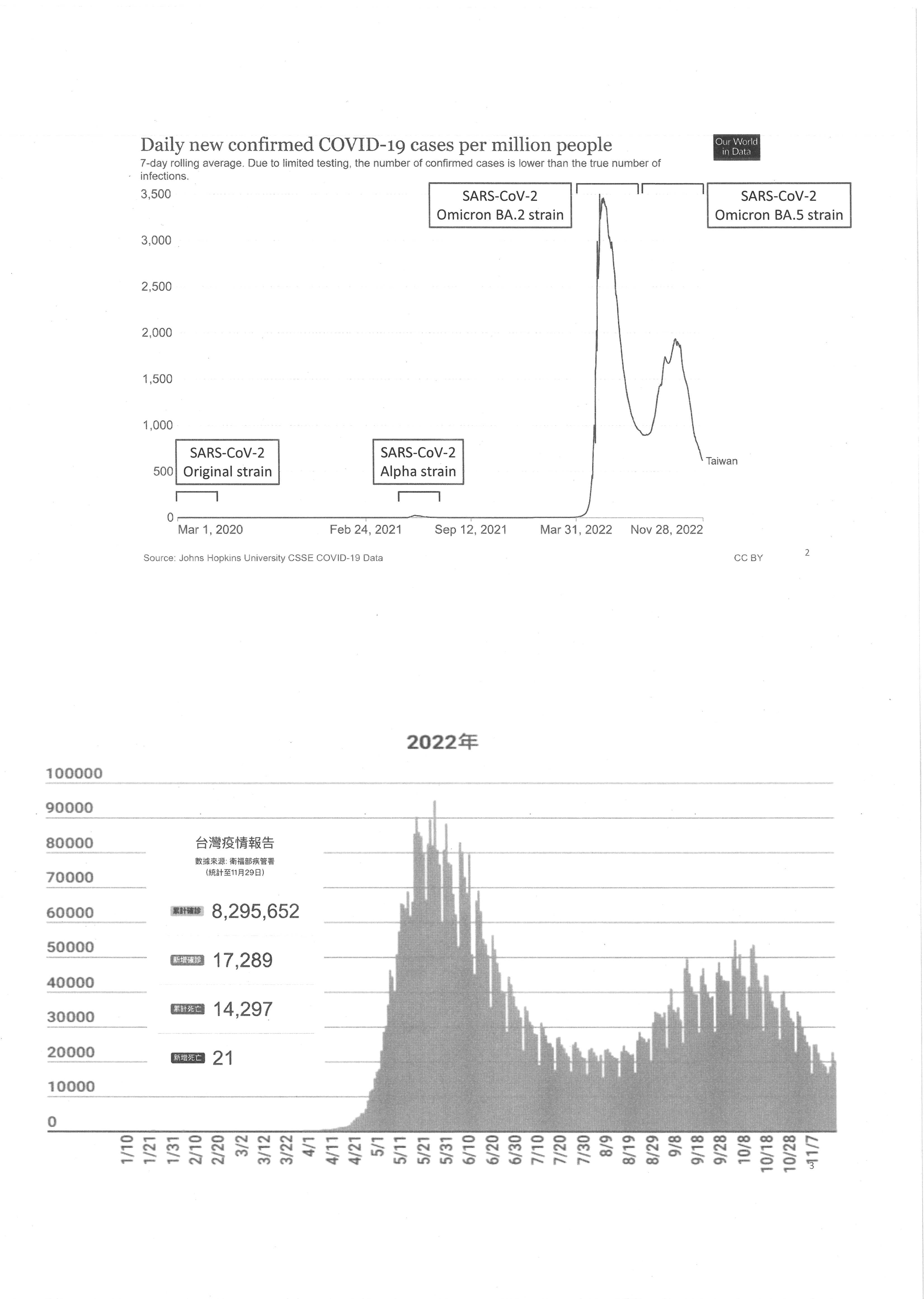
金傳春兼任教授:主席、各位與疫情有關的官員、在座的學者專家大家早安。我先提出八個與疫情相關的問題,之後會以幻燈片稍微講解一下疫苗評估的重要性。
首先,當Delta病毒進入屏東之初,那時候做得很好,並在非常短的時間內控制住,因為屏東快速施打疫苗。但為何雙北疫情吃緊時沒有這樣做,以致未能將重症及死亡率降低,這是第一個問題。
其次,國際上所規劃的疫苗臨床試驗都必須做三期,我國已經補助了兩期,到了第三期卻零補助,而且在前兩期補助之後還增加了樣本數,這點請參見我在遠見雜誌所寫的文章。國際上非常重視第三期試驗結果,因為第三期涉及疫苗保護力問題,所以我想問,為何我國的作風與國際背道而馳?
第三,對於新冠疫苗的免疫評估,也就是給予緊急授權時,其實已經在雙北流行之後,所以為什麼不去看變種病毒及疫苗免疫之持久力?不僅如此,給EUA的時候,是在國產疫苗施打之後的兩個禮拜,此時仍在抗體高峰,所以我們該擔心的是抗體下降,為什麼不這樣看?像UB-612對變種病毒、對T細胞免疫的持久性、中和抗體的效價都非常好,為什麼食藥署一直不重視?即使我曾經私底下溝通過,但還是無效!
第四,就新冠變種病毒來說,過去我們都是看到其他國家有變種病毒後,我們才開始做偵測,這是屬於「被動偵測」,因此,當有新變種病毒於國內產生的話,請問我們有沒有提早發現的能力?改進作為為何?
第五,疾管署在2003年SARS流行後,與臺大和國衛院研發了症候群偵測,也因此,疾管署在2009年新型流感H1N1流行時,每週可看到不同年齡層的流行趨勢,真的做得非常好,為何這次新冠疫情卻完全沒有看到data presentation?畢竟這對社區防疫來說非常重要,可以讓社區動員起來,為什麼會全廢武功?
第六,食藥署是否有相關機制,可以在發給新冠疫苗EUA過程中瞭解有何改進之處?進而精益求精?
第七,未來民眾施打疫苗是否需要無止盡的打?也就是第四劑、第五劑,一直打追加劑?抑或有更好的方法?有沒有想到更好的方法?
第八,今冬將有人流感、禽流感與新冠疫情三箭齊發,所以今年冬天的防疫有哪些更積極、對民眾健康有幫助的作為?
施打疫苗是為了達到公共衛生的四大目標:預防感染、防止傳播、防止中重症及死亡、防止長新冠。但現在所看到的data只能防中重症及死亡,無法預防感染、無法防止傳播,亦無法防止長新冠的發生。以我們所施打的疫苗來看,一開始是AZ疫苗,後來是mRNA疫苗,之後才是protein-based的國產疫苗,也就是高端疫苗。但這裡面有一個很大的問題,也就是腺病毒的高峰比較低,至於mRNA則是有人會脫髮、會突然來月經,甚至以前所沒有的病症統統都出來了,卻還是被突破性感染。
現在所有國外進來的疫苗以及目前核准的國產疫苗都是spike protein only,這並不足以對付Omicron!事實上,早在Omicron BA.1、BA.2進來的時候就已經差四十幾個氨基酸。正因如此,新聞上講說現在接種率已經到達多少時有個問題,那就是我們這種接種率全部是spike protein武漢病毒株的接種率,不要混淆大家,所以能不能夠真正抵擋Omicron,其實還有一個距離。最近60位重量級的科學家跟FDA提出建議,請食藥署要去注意喔,他們建議在疫苗的審查時要加入T細胞免疫,這我溝通了很多次,他們都不理我,為什麼呢?事實上,關於你的病毒,因為突破性感染很多嘛,就會進到細胞裡面,進到細胞裡面之後,你真的就是靠T細胞了,尤其是T殺手細胞。
請看下一張,所以在抗體反應誘發antibody weight的時候,這時候T細胞又很有作用,尤其對於變種病毒。請看下一張,這個東西因為簡報檔都有,你們到時候可以去看。請看下一張,所以我們真正對抗免疫力的時候,過去我們EUA的時候是看antibody,然後又去跟AZ疫苗相比,但現在AZ疫苗在世界上已經不打了,我們事實上應該要看這個的number of T cells。請看下一張,為什麼呢?因為進到細胞裡面,T細胞,尤其T殺手細胞,CD8+ T cell它的記憶免疫非常久,然後它可以殺細胞內的病毒。請看下一張,所以我們需要這個高品質的T細胞免疫來去確定我們的疫苗評估。請看下一張,尤其在這個圖,大家有沒有看到這個虛線就是antibody開很低的時候,你有T細胞免疫,你還是可以,所以我們食藥署的EUA用的是比較是immuno bridging,可是只看antibody,antibody對麻疹病毒、小兒麻痺病毒,確實對小朋友是很有用,可是不要忘了,我們的新冠是打各個年齡層,所以我們要考慮的比較多,所以很重要一點就是T細胞有一些抗原的決定性antigenic determination,也是一樣的。
請看下一張,這邊大家就可以看出來,UB-612它事實上對Omicron BA.1、BA.2,它的titer是最高的,請看一下幾何平均效價,再看下一張,它對BA.5也是最高的。再看下一張,同時你可以看到,它最主要是有m蛋白及n蛋白,它不是只有spike protein,這一點請大家注意。請看下一張,所以你要夠用功,夠用功去追這些data,左邊就告訴你是用antibody,右邊告訴你T細胞免疫,事實上我們真正對付Omicron,T細胞免疫才是最重要的。請看下一張,這裡面就是給大家看,我們國產的UB-612,它的antibody持久性半衰期187天,比mRNA疫苗不管是BNT或莫德納都長。請看下一張,為什麼它會這樣?因為它有T細胞免疫。請看下一張,而且它所產生的Th1做ELISpot你也可以看到它的data。請看下一張,這裡面的Th1免疫細胞就可以,甚至可以看到它的毒殺作用,最右邊。請看下一張,而且用猴子攻毒,猴子攻毒什麼意思?就是看T細胞跟protection(保護力)事實上的相關性。請看下一張,所以將來臺灣應該要去鼓勵、去develop T細胞疫苗,Pfizer最近就announce他們要這樣做,而且是廣效性,廣效性是什麼?針對不同的變種病毒。請看下一張,事實上他們申請了,可是每一次都遭食藥署否決。請看下一張,否決的理由也不是很清楚,也沒有什麼科學根據,事實上你看現在美國FDA,UB-612已經到美國去做第三期臨床試驗,所以我們是把臺灣的機會讓到國外去了。請看下一張,所以你看到這個第三節data就告訴你說,它事實上比我們原先的AZ疫苗或者是中國的滅活疫苗或者是mRNA疫苗,甚至都好。請看下一張,所以我的意思就是說,我們有這麼好的疫苗可以保護我們自己國民的健康,又能夠去做國際衛生,去幫助全球其他國家減少死亡,何樂而不為?謝謝大家。
主席:請林委員靜儀發言。
林委員靜儀:謝謝召委,也謝謝今天所有與會的專家學者。COVID-19已經到了將近第三年了,現在我們所希望的就是,除了今天在委員會討論過去這三年的整個防疫狀況之外,也希望能藉由今天的公聽會可以往下去談未來我們怎麼看待COVID-19的疫情,因為畢竟我們不可能一直停留在過去,我們必須要往前走。
首先我要播放一段影片。
(播放影片)
林委員靜儀:這是美國智庫CSIS在將近半年多之前的一個訪問,講話的這一位就是之前來臺灣拜訪過很多次的美國國會議員,這個資訊已經講了很多次,應該是從2020年底一直到2021年,國內就一直不停地在繞著買疫苗的事情,我認為像這樣的資訊,其實衛福部手上都有,但是傳播力不夠,所以在今天的公聽會,我藉由這個機會讓大家再看一次,其實國際社會都比我們看得還要清楚。
再來,國內有一些人在談保護力,甚至這兩天還有人提到包含疫苗的品牌等等,我還是用一下衛福部、指揮中心在今年所提出來的,至少以全國人的相關統計數字來說,各個品牌的疫苗,我相信所有醫療界,今天在場的都是醫療界的專家,以醫療界來說,基本上我們很多事情,尤其是面對這種新的事情,大概都是事後諸葛!如果以衛福部所提供給我們的這樣一個資料來看,這是今年11月18日提出來的,就是在臺灣已經可以接種到三劑以上疫苗的時候,當然之前就提過,不分年齡來講,在疫苗的接種裡面,不論是我們所說的高端、BNT、莫德納,這三支大概是我們目前看到在數字上不分年齡的疫苗保護效力相對不錯的。但是我會建議大家往後看到最右邊那一欄「65歲以上」,我想這一次的疫情走到現在,我們花了最多的精神都是在看65歲以上,所謂脆弱族群被保護的狀況,以脆弱族群被保護的狀況來講,在我們沒有辦法得到其他疫苗的時候,我們希望能夠儘量保護65歲以上長輩,我們看65歲以上一開始打AZ疫苗的,事實上它的保護效力並沒有那麼好,反而是到後面我們開始有莫德納、高端、BNT之後,65歲以上長輩施打疫苗的保護效力才會好,但是這個叫事後諸葛,因為當我們全臺灣只有一個疫苗可以用的時候,我們國產的還沒出來,進口的其他品牌買不進來,我們只有AZ的時候,我們當然優先保護脆弱族群。
我想這些數字在現在這些資訊的情況之下,對於這種大表單,大家可能不會仔細地一一去看,但是其實從這個表單裡面,我還是很高興國內衛福部跟指揮中心能有相關數據出來,事後諸葛會認為那時候65歲長輩施打AZ的保護力其實不夠好,但是如果我們用當時的整個狀況來看,那個時候不給長輩打AZ,就是讓他們在幾乎完全沒有保護狀況下去接受病毒的侵襲。
還是一樣,藉著這張表,我也拜託大家看一下,不要有品牌的迷思,因為如果我們從65歲以上長輩的疫苗保護效力來看,事實上在這張表裡面看起來,三劑莫德納跟三劑高端的效力事實上是高的,這個是這裡面的數據,我至少將這些數字藉由今天的公聽會跟大家做分享。
當然,還是有一些檢討的部分,我也要藉由今天的公聽會向衛環的召委及今天在場的所有官員再一次強調,在這段時間裡面我們做了一些很正確的事情,比方一開始疫情來的時候把口罩控管給醫療人員,把口罩控管讓民眾不會瘋搶,至少讓大家該有口罩的時候都有,這是2020年的事情。到現在我想大家抱怨最多的還是給付太慢,也就是我們該給醫護人員或相關防疫人員的優惠、補助等等的給付太慢,以及對於醫療單位的一些相關政策拖得比較久。到現在為止,我希望能儘快的重新調整每間醫院對於COVID-19確診者的手術等等治療是不是還要用那麼高規格的一些標準,因為這個事實上都是耗費物力、人力成本,甚至控管特殊病床。我知道我們正在因應中國的疫情,可能臺灣要準備接下來會不會受到影響而再讓疫情有所波動,但是我希望包含給付的部分是不是能夠儘快撥給應該給的醫療人員,第二個就是在相關醫院裡面的感控流程部分,事實上該鬆綁就鬆綁。
最後,藉由今天的公聽會,我要提醒一件事情,接下來我們要面對的是新流感世代,我想這個COVID-19的病毒會跟著全球人類好長一段時間,它只會不斷地突變,所以衛福部及我們的專家學者應該要思考的是,像現在剛好是流感季節,不是把流感分一塊、把COVID-19分一塊,是不是要做一個新的流感世代的看待?我們過去對於流感的看法就是時間到了打疫苗,再來就看有哪些症狀讓醫師懷疑你是流感的時候做流感快篩,流感快篩完給藥,之前是給克流感,給了藥之後不會強制要求你一定要隔離等等,我們以前對於流感是這麼做的,所以要請衛福部跟所有的專家趕快去思考,接下來面對新的流感世代,COVID-19可能會變成流感之一,它未來是不是也跟其他流感一樣,有症狀再去進行所謂醫療院所的相關篩檢,篩檢之後,其實不需要做這麼嚴格的限制行動的動作?最後,是不是在給藥方面能夠跟之前的特殊管控狀況不一樣?給藥的部分就照應該有的indication,該給就給,但是減少這種又要隔離又要想辦法視訊給藥的流程。現在12月了,我希望至少在過完農曆年,我們來看看疫情的狀況,如果相對穩定了,是不是請指揮中心也該把COVID-19列為流感之一,而用相對的新流感世代的方式來看待COVID-19的疫情跟每年的季節流感?以上,謝謝。
主席:接下來請中華民國醫師公會全國聯合會顏鴻順常務理事發言。
顏鴻順常務理事:主席、林委員、洪委員、薛部長以及各位長官、各位學者專家大家早安。非常感謝張育美委員今天召開這場公聽會,就像主席一開始的開示,面對過去的疫情,我們要虛心檢討;面對未來,我們要吸取經驗,建構堅韌健全的醫療防疫體系。就像臺灣經歷了2002年、2003年那一場SARS的洗禮,之後我們也做了很多檢討,比方說我們的指揮中心,比方說我們統一的媒體說明,比方說我們的防疫醫師,比方說我們各種防疫體系的建置及專責病房建置等等。所以在這次的疫情之初,我們因為過去的經驗而能夠很快地應變,很快地面對這樣一個疫情的侵襲。針對今天所提的這些問題,全聯會這邊也有一些回應,我就按照這樣的順序來做個說明。
提綱一是有關振興特別條例第七條所定之處置或措施是否有違法律明確性原則的部分,全聯會的法律顧問所提供給我們的意見如PowerPoint上所寫的,參照大法官釋字第690號解釋等等。我們比較要討論的是第二點,疫情期間禁止醫護人員出國、國人入出境限制、口罩禁令、居家隔離、實名制、醫療機構探病管制等等措施,是否符合振興特別條例第七條所謂「必要之應變處置或措施」?是否有憲法上「保障人民遷徙自由」的疑慮?當然,這一點在社會上有非常兩極的辯論,所以我覺得這一點也是日後我們可以思考的一個問題。
提綱二是有關COVID-19疫苗採購程序的檢討,誠如剛才林委員所提到的,臺灣所面臨的國際困境,尤其是在疫情一開始的時候,各國是瘋搶疫苗,再加上臺灣的困境,不只困境,而且還有對岸刻意的打壓,我想大家都知道,所以在那個情況之下,有很多的作為恐怕不是我們想的那麼順利可以進行。但是全聯會這邊有幾個建議,第一個是建議在緊急採購疫苗時,以符合政府採購法等相關規範為原則來進行;第二個建議是經由這次的實務經驗,能夠建立將來如果面對這樣一個突發疫情的時候,我們要怎麼樣緊急採購,其合宜的程序跟機制是怎麼樣,也能夠受到社會的公評;第三個建議是要研議於不違反保密條款及國家利益的情況下,適時公開疫苗採購執行的狀況,以穩定民心,也增進採購資訊的公開跟透明。
提綱三是有關國產疫苗的部分,我想國產疫苗、高端疫苗引起的社會爭議也非常大,但是我們要思考,在面對一個不可知的新興傳染病的時候,如果我們把國產疫苗當作是一種戰略物資,其實是值得我們國家投入更多的關注跟資源,甚至我們自己研發的疫苗比從國外買的疫苗還貴都有可能,因為要投入更多資源去研發,而且我們的市場是更小的,但是所面對的是,將來如果各國在搶疫苗的時候,我們有自己的東西可以用,我們有自己的子彈,當然,如果能把它做得更好,甚至可以幫助世界上很多國家或者外銷到很多國家。所以我們全聯會的建議是,第一個,政府應該訂定符合國際規範的疫苗EUA與認證準則,才能跟國際接軌;第二個,我們也建議針對國產疫苗的開發應該要達到三期的臨床試驗,因為這是國際標準,想要跟國際接軌,這一點是一定要做的,同時透過國際合作,幫助我們的國產疫苗去獲得國際認證;第三個,我們建議藉著這次的爭議,希望能召開新冠疫苗全盤規劃研討會,以集思廣益。
提綱四是有關疫苗接種的救濟部分,我們有五點的建議,第一個,我們建議成立一個專用基金來處理COVID-19疫苗及其相關衍生的問題,同時應編列預算來挹注受害救濟、推動疫苗事務及相關行政必要費用;第二個,我們建議盤點法制相應規定,由於緊急授權的疫苗相關法制不足,所以建議藉著這次的經驗,或許可以從防疫相關的特別法規予以修訂,在制定規範時,為鼓勵民眾施打,對於關聯性、嚴重程度的審定應該要適度從寬;第三個,建議調整制度提升通報的效能,施打疫苗之後產生的各種狀況,或許我們可以考慮比照職災,由專業的專科醫師來做是否是疫苗不良反應的判定,甚至建立通報或獎勵機制;第四個,希望能精進審議行政作業,就像在這個過程當中,對於是否為不良反應,國家並沒有認真地看待這個問題,而是透過社團法人國家生技醫療產業基金會發公文到所有院所來索取,一開始我們都以為那是詐騙集團,後來詢問才知道真的有這樣一個單位,它也沒有給任何的行政成本,而且是用略帶威脅的口吻表示,根據某某條例第幾條,如果二個禮拜不提供資料將會有相關罰則,這個也在基層引起相當多的反彈;第五個,建議強化民眾宣導溝通,就像當初阿中指揮官一直講的,時序關係不等於因果關係,關於很多疫苗的不良反應,但是民眾可能聽不懂,所以我覺得這方面的宣導要更加強。有關提綱五醫療量能調度之檢討,我們建議防疫物資的發放應以第一線防疫人員為優先,由衛生局或各縣市醫師公會協助發放。
第二個,抗病毒藥物的配發希望能夠更全面,比方說以第一線使用的Paxlovid為例,在新北市一千七百多家診所裡頭,有六百多家診所在做居家照護及開立抗病毒藥物,但是只有二百家診所有配賦Paxlovid。至於Molnupiravir這個藥我認為更應該檢討,因為醫療院所、診所不配賦,而且醫師不能把處方釋出給藥局去領或讓病人自己去領,必須由醫療單位自己派人去醫院領回來,然後再叫病人家屬來領,整個過程非常地繁複也很麻煩,所以醫療院所普遍都不願意或者很難開立Molnupiravir這個藥。
第三個,將來疫苗的施打應以第一線防疫人員及同住家屬為優先。另外,有關防疫獎勵、補助的發放,我們都希望從寬、從簡,而且獎勵的額度應該要充足。
臺灣至今有九百多萬人確診,但是我們的社會沒有人心浮動,沒有社會動亂,我們的經濟活動還是照常,而且在疫情期間,甚至高達92%的民眾對臺灣的健保以及醫療體系是滿意的,這表示臺灣其實有非常堅韌的四級醫療體系來照顧九百多萬個每一個確診的民眾,所以我在最後也要報告,全體醫護將持續堅守在第一線來守護民眾的健康。以上報告,謝謝。
主席:請玄奘大學法律學系蔡震榮系主任發言。
蔡震榮系主任:很榮幸今天能夠在此跟各位做個報告,我將報告第一個提綱跟第二個提綱,至於其他的提綱,第四個提綱可能會簡要說明一下。這一次會議應該是各項防疫措施實施3年以來的一個檢討會議,其中第一個提綱問及嚴重特殊傳染性肺炎防治及紓困振興特別條例第七條的法律明確性,剛剛醫師公會理事有提出來,醫護人員限制出境這部分應該不明確,因為它是一個法規命令,而第七條是類似一般處分的性質。
如果檢討整個緊急應變措施,各位可以看到紓困條例這個法律應該是給衛福部用的,但是各位如果去看一下,不只衛福部,包括入出國移民署、陸委會、交通部、勞動部全部都用到紓困條例第七條,這很奇怪。為什麼會用到紓困條例?因為衛福部找他們來開會,然後透過會議決議把紓困條例第七條弄上去,所以管轄就發生問題。這個法律沒有問題,法律是要提供紓困,要給它緊急應變措施,但是緊急應變措施是指揮中心的權限不是各部會的權限,而我們把它容許給各部會,這個是有一點問題。
我們如果看第七條的規定,反而衛福部用得比較少,在這次處理疫情的過程中,衛福部用的都是傳染病防治法,所以它是兩個法交叉使用。這個很奇怪,因為一個是緊急法,另一個是平常法,緊急法是在平常法沒有用的時候才用,所以日本在定新冠肺炎緊急防疫條例的時候會訂期限,就是兩年得延長一年,我們立法院是有說要加以檢討,其實現在應該也可以檢討是否把紓困條例做個結束,回歸正常,因為現在的狀況比較特殊。
這是我要提到的第一點,因為第七條已經在法律界討論過很多次了,這個法條符合明確性的要求,但是實施不明確,這點給各位參考一下,因為違反管轄。尤其叫警察人員去查開疫苗的單子,那也是違反規定,哪有這樣子的?我這一次參加東亞行政法學會,我就問日本跟韓國學界,他們說警察不做防疫的,我們臺灣是很奇怪的作法。
另外,討論提綱二有關疫苗採購的公開,剛剛理事長也講過,那是緊急採購沒有錯,但是各位要知道,緊急採購仍然要公開,因為它適用政府採購法,我們的政府採購法就是要透明公開。剛剛那位先進講到第八十四條,第八十四條講到有商業秘密的話,就商業秘密的部分不公開,但是其他部分也是要公開,所以這次選舉打疫苗是打對了,因為全部都不公開,要等到30年以後解封,這不符合政府採購法的規定。為什麼?我們扶植國產疫苗是對的,但是疫苗的採購程序分好幾種,有一種是我們要跟外面買,外面不給你買,這是一種;一種是郭台銘在講的BNT的疫苗,那個不適用採購法;另一種就是跟高端簽約,高端是政府主動跟它簽約的,這方面的資訊是不是有商業秘密的問題?所以採購疫苗的時候要分,這是我們要檢討的。
當然要扶植我們的國產疫苗,這我們贊同,尤其剛剛立法委員提示的,但是衛福部應該考慮一下,有哪些資訊可以公開、哪些資訊不可公開,不能全部說因為是緊急採購而不公開,而且政府採購法的規定也沒有限制全部不能公開,如果你們去看施行細則第八十四條的規定,它有講不公開的部分應不納入,但是其他的應該要公開,所以這部分其實可以再檢討、再改進。以上是我的報告,謝謝。
主席:請洪委員申翰發言。
洪委員申翰:各位專家學者、衛福部及指揮中心代表,今天很榮幸有機會舉辦這個公聽會。防疫整體的回顧跟檢討當然十分重要,我們看到這3年來很多疫情的衝擊來得非常急、非常快,其實也跟20年前面對SARS的處境有很多的不同,很多時候衛福部跟行政單位因為顧及反應的效率,所以跟社會的溝通比較少,我覺得這部分不是不能體諒,但是我們需要傾聽大家的意見,而且你們也需要拿出一些誠意,實際去理解並跟民間的需求做一些對話。我今天主要講三件事情:第一個,根據臺灣感染症醫學會的統計數據,目前感染症專科醫生報考人數的趨勢是越來越少,從2010年的46位到現在2021年只剩下20位,也就是說,十年來感染科的報考人數是直接砍半,許多醫學中心甚至一年新進不到1位醫師接受感染科的專科訓練。大家都知道感染科絕對是防疫最重要的角色之一,但是感染科並不看做幾個心導管病人、照幾個胃鏡、接生幾個小孩或開幾顆藥,其實它是很難度量的,可能常常不被醫院認為是有正向績效的科別,簡單說就是不被認為是可以賺錢的科別。如果感染科的醫師少到幾乎沒有人了,一旦接下來再發生新興的或全球性的傳染病,我們要如何面對及處理?
本席認為,衛福部應該要針對這個現象未雨綢繆,對於人力的配置訂定完整的對策。如果仔細去看,現在感染科甚至不是衛福部的部定專科,因此無論是評鑑制度、考選制度或健保的點值方式,衛福部應該要提出完整及務實的政策,藉以提升年輕醫生進入感染科的誘因,這是今天本席想說的第一點。
第二點,我們的紓困條例大概再半年就要退場了,前一段時間薛部長曾說過下個月會把部版的傳染病防治法修正草案送到行政院,可能也會縮短部版的預告期。當然要讓傳染病防治法跟上實務的運作,尤其是在這次百年大疫的經驗之後,本席自己非常認同,但也要提醒衛福部,在這次COVID-19的防疫過程中其實有許多反映的聲音,中央公布的政策、指揮中心公布的政策,與縣市的衛生局、衛生所及地方的衛政機構,在運作上其實出現了許多實務上的困境。這個實務上的困境在當時很快速的反映之下,其實不一定都有條件被好好地處理,因此這次部版傳染病防治法草案的訂定,有沒有清楚完整地納入這些基層衛生局、衛生所甚至是檢疫所、醫院醫護人員的想法以及他們實際的處置與經驗?有沒有辦法真的好好呈現在這次部版的版本中?本席認為,這個部分需要部長與衛福部再好好地思考,如何讓他們的意見可以清楚地反映進來,成為一部更完整、更具經驗導向的傳染病防治法?而且這個部分會是接下來傳染病防治法修法關鍵中的關鍵,希望衛福部、也希望部長能將這樣的意見清楚地反映進去。
第三點,我們其實召開過幾次與醫療相關的公聽會,很遺憾,這次的公聽會還是沒有任何護理人員代表。護理師是全國人數最多的醫事人員,坦白說,他們的心聲常常被忽略,就像今天出席的大部分還是醫師。在照顧病人的過程中,他們其實是最長時間接觸病患的醫事人員,疫情期間也不斷反映護病比太高的問題,包括現在全日護病比的制度也有很大的改善空間。因此在這次衛福部的預算審查時,本席也提案要求衛福部必須盡速就2025年朝向三班護病比的立法目標,希望能夠廣邀基層醫護人員代表的參與,讓第一線上白班、夜班及大夜班的護理師及照顧不同科別的護理師能有好好表達自己意見的機會,不要再像今天這場公聽會的組成,希望衛福部在制定政策時不要再忘記傾聽13萬名護理人員的聲音,以上是本席今天的三點建議,謝謝。
主席:等下在邱淑媞教授發言結束後就請薛部長回應,之後就休息10分鐘。
請中華民國基層醫療協會羅源彰秘書長發言。
羅源彰秘書長:主席、各位來賓、各位官員、各位專家學者大家好。我是中華民國基層醫療協會秘書長羅源彰,今天我要發言的內容其實非常非常小,但是每一天都會在基層醫療院所遇到,什麼樣的事情呢?其實剛剛顏鴻順理事長也已經提過,關於抗病毒藥的發放流程,我個人認為有非常嚴重的瑕疵。這個問題是含括在今天討論議題的第五項,請大家參照第11頁,首先向各位解釋一些背景資料。
目前診所發放的抗病毒藥主要有兩種,一個是Paxlovid,為了讓大家好記,這裡就簡稱為P;另一種是Molnupiravir,我們就簡稱為M。P這個藥的殺病毒能力比較好,但是它有許多不方便使用的適應症,譬如這個病人可能同時服用8、9種慢性病藥物,所以這個藥可能必須減量或改用。M這個藥的效果雖然比較弱一點,但它的適應症比較廣,也就是與許多藥都不會起衝突,雖然它的效果是差了一點。因此我們都會先選擇使用P,無法使用它的時候,我們才會改用M。現在問題來了,診所不能配置M這個藥,如果病人有這樣的適應症需要使用抗病毒藥,我們會告知病人要用這個藥,但是診所沒有這個藥,大家不要懷疑,診所就是沒有!診所醫治確診病人的比例可能超過60%至70%,我們每一天都會碰到這個問題,碰到病人就要講一次、碰到病人就要講一次,診所人員就要利用休息時間到核心藥局或有配置的地方去拿藥,再打電話告知病患需要的藥來了,拿一盒銷一盒、拿一盒銷一盒,請問要花費多少的時間?
因為這樣的不合理,今年11月2日中華民國基層醫療協會就發了文,主旨是建請衛福部精簡基層診所申請口服抗病毒藥Molnupiravir的流程。誠如我剛剛所言,這樣的處方對我們而言非常不方便,而且醫師也都知道,Molnupiravir的效果比較差,我們是逼不得已才會開這個藥,雖然P這個藥的效果好,但有些人就是不能用,所以我們必須要用M這個藥,問題是整個流程非常麻煩。後來協會在11月17日得到了指揮中心的回復,因為本藥品非口服抗病毒藥首選,而是以主要提供血液透析、思覺失調等無法替代其他藥品的病患為主。我先說一件事情,根本就不是為主,除了這樣的病患之外,還有很多很多會產生藥物交互作用的病患,必須要花費許多時間向病患解釋等等,醫師有時候會想算了就乾脆退而求其次,況且病患也記不住這麼多的適應症啊!在這樣的狀況之下,我們訴求的是便利性,但指揮中心的回復是它並非首選,根本沒有對到我們的request,所以我們就在想是不是發文沒有寫得很清楚,於是在隔天11月18日又再發一次文,建請再次審視口服抗病毒藥Molnupiravir的申請流程,這次就寫得很清楚,明明白白,並不是只有血液透析或長照機構的病患才能拿這些藥,雖然指揮中心在這些地方也都設點可以使用Molnupiravir,但顯然基層醫療院所還是沒有,而且我們一天到晚都會碰到這樣的病患。結果又過了2個禮拜之後,指揮中心又回復一樣的理由、一樣的原因,認為Molnupiravir這個藥品並非口服抗病毒藥的首選,故不以處方釋出的方式提供,也就是說,基層診所就是必須派人到特定地方領藥,碰到一個病患就跑一次,早上碰一個就中午跑、下午碰一個就晚上跑、晚上碰一個就隔天早上再跑一次,我們光是跑這些Molnupiravir的藥就真的是夠了!
對於這樣麻煩的方式,剛開始大家可能都還願意配合,但是久了之後,請問醫師會怎麼做?只有2個字:算了!我就告訴病患,看起來不是那麼嚴重,我們就先觀察看看,你要是真的變很嚴重就送醫院,所以Molnupiravir一直被閒置著,使用率偏低不是沒有原因的。
另外一個是病患家屬的部分,因為嚴重影響到他們的權益,病患家屬會覺得奇怪,為什麼醫生不肯開抗病毒藥物給病人?沒辦法啊!P這個藥雖然效果好,但它可能無法使用,所以我們要開M這個藥,不好意思,非常麻煩!我們還要跑去拿藥,而且哪個診所醫師有這麼多人力可以跑這件事情呢?最後病患也只好同意再觀察看看,真的有需要時就趕快向醫師request。這樣的作法對於疫情也不是那麼地有助益,所以本席認為這是一個三輸的結局,以上報告,謝謝。
主席:請國立陽明交通大學醫學系邱淑媞教授發言。
邱淑媞教授:主席及各位列席官員、各位專家學者、各位記者大家早安。首先要感謝行政團隊在這段期間非常地辛苦!這個疫情是全球關注,也是社會注目的焦點,我個人過去曾在行政機關工作,對我而言非常重要的一件事就是依法行政,依法行政是最重要的,在防疫的過程要依法行政、在檢討的過程也要依法檢討。針對今天公聽會提到的幾個議題,我特別著重在政府防疫權責及第二、第三點關於疫苗的採購及核准,另外就是用藥的部分,我準備了一些投影片。
關於政府的防疫權責,大家也都已經提過,怎麼會已經有了一個傳染病防治法之後,卻又有一個紓困特別條例?無異是在防疫上又開了一個特權條款,也就是這個第七條,這樣的條款在國際上是很特別的,因為國際上連強制大家戴口罩都是相當審慎。其實我們的傳染病防治法已經有很多賦予的規範,但是沒關係,如果是這樣的話,大家一定會認為是為了要防疫,因為它講到一個前提,防治控制疫情需要,無論如何都支持你,所以得再做額外的處置或措施。大家對這個部分已經談了很多,我認為既然是這樣,傳染病防治法都還嫌不夠,那麼傳染病防治法能不能不做?積極面是賦予它更大的權限,但消極面是要看有沒有瀆職的問題。因此,一個是濫權,我們必須要看有沒有瀆職?如果是瀆職就要看法定傳染病的規範;另外一個是疫苗的部分,因為疫苗是一個藥物,而我們有藥事法啊!有沒有照藥事法的規範去做?
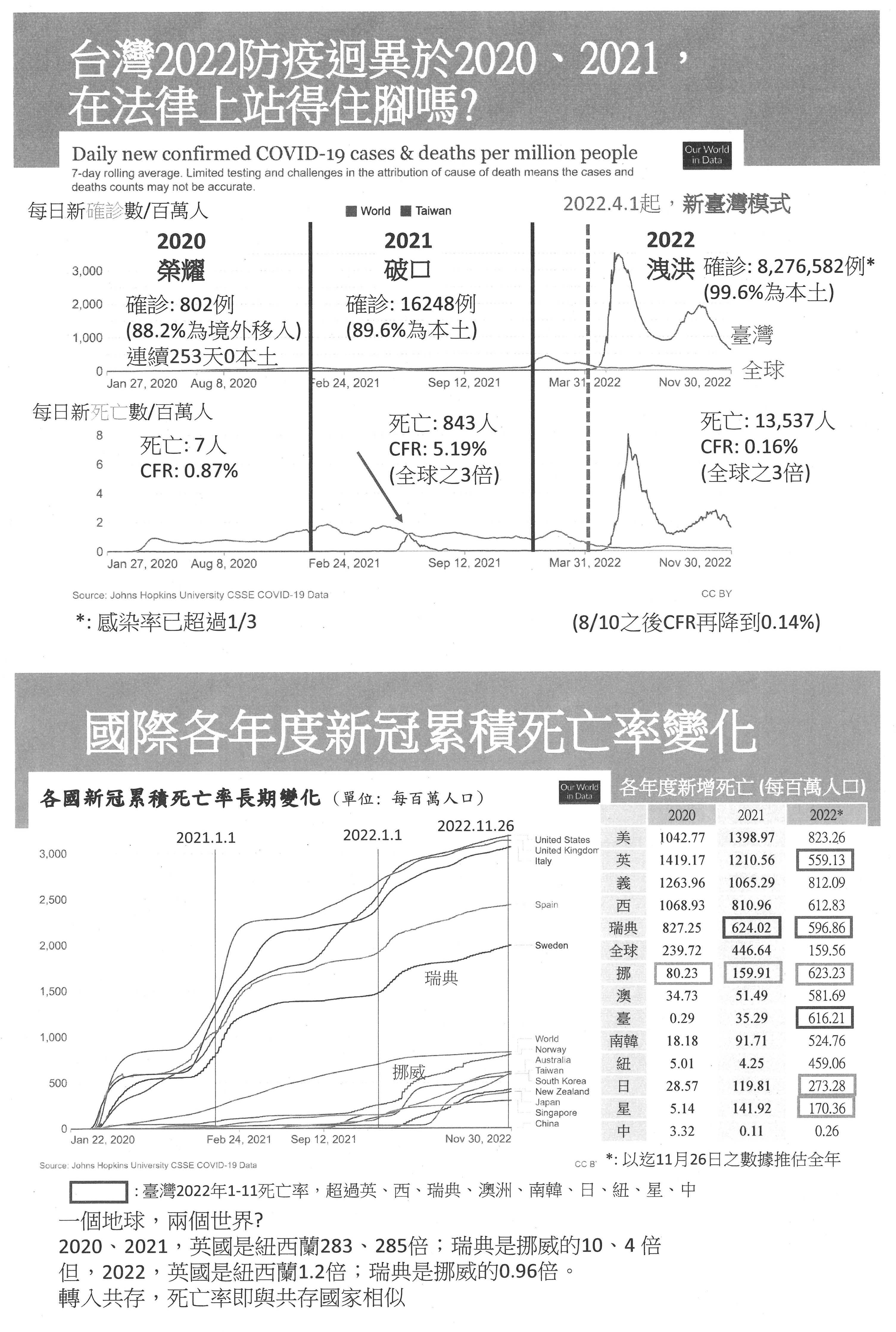
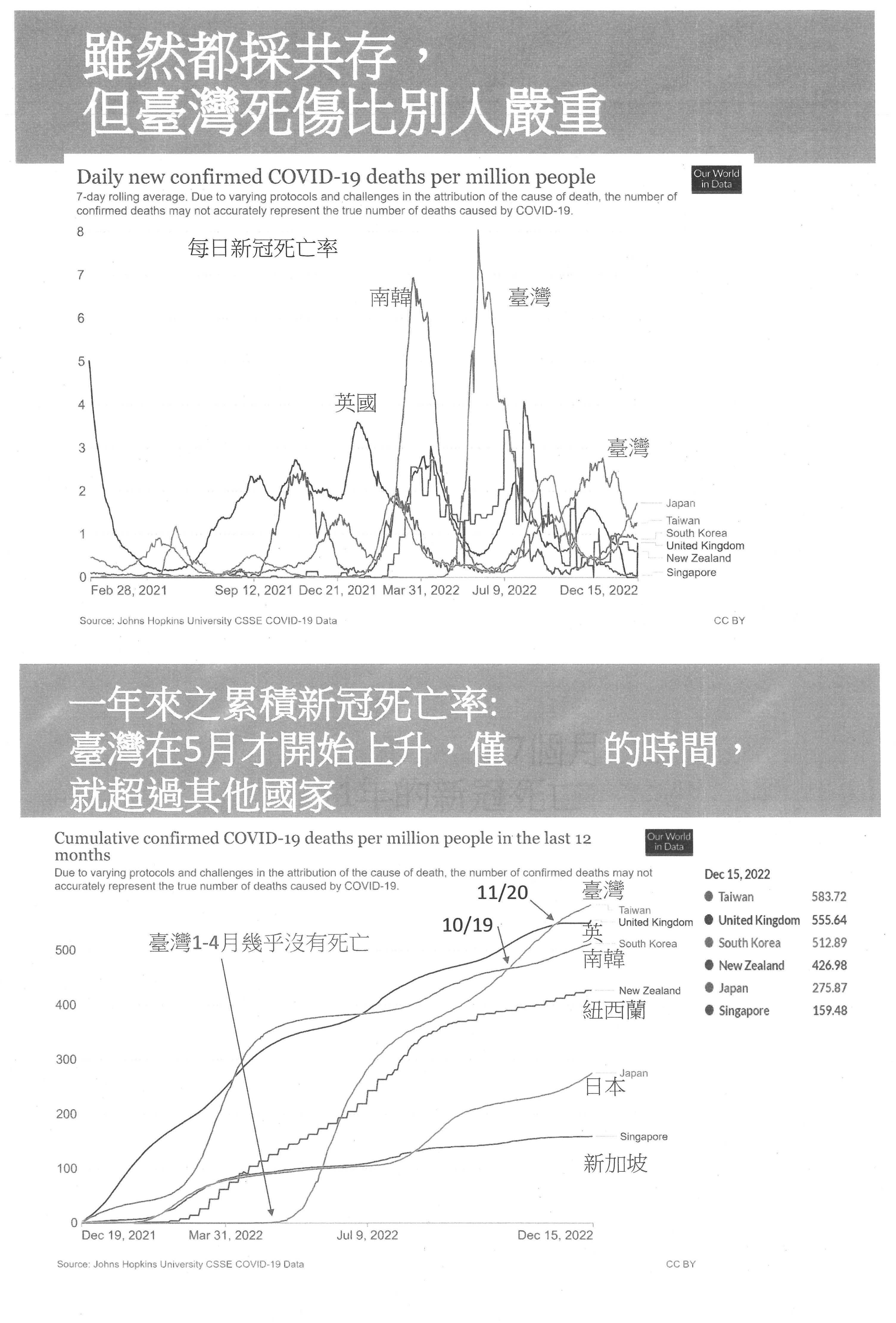
我們的防疫其實是分成兩大階段,請大家看一下,在三年的期間,上面是確診數、下面是死亡數,每一個圖中綠色的是臺灣、紅色的是全球,我們很清楚看到新臺灣模式是一個分水嶺,前面我們的疫情控制都優於全球,在新臺灣模式之後,我們非常明顯地、很突兀地比全球更嚴重,而且我們主要的確診與死亡都是發生在新臺灣模式的期間。政府每次都告訴大家,以累積死亡率來看新冠肺炎的累積死亡率,我們是表現很好的,但是如果將三年切開來看,前兩年確實是很好,如同我剛剛講的,第三年的新冠死亡率其實比很多國家都高。如果以每日死亡率來看,大家可以看到這個橘色的是臺灣,其實都很清楚。如果用最近這一年的新冠累積死亡率來看,各位就可以看到我們從新臺灣模式之後才開始有明顯的死亡,在5月份之後,7個月的時間內就趕上了別人1年的死亡數,7個月追過了包括英國及南韓的死亡數。一樣與病毒共存的時候,紐西蘭、日本及新加坡的累積新冠死亡率比我們要低很多,所以我們並不是因為要走向正常化就一定要死很多,沒有,我們是不正常的死亡,在所謂全民正常生活之下產生的不正常死亡。
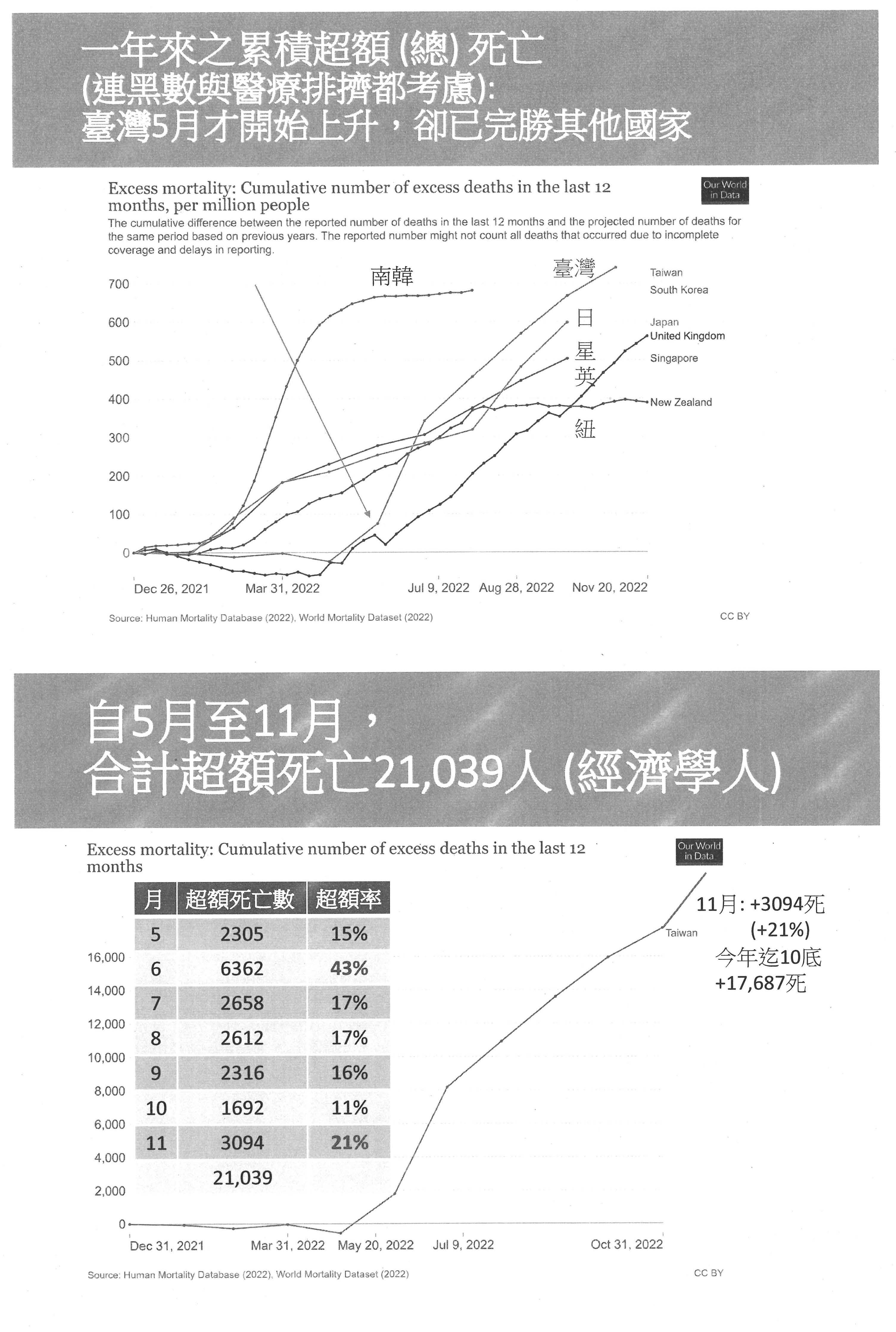
如果用超額死亡來看,因為大家說有時候會有黑數,只要是死都算是死,累積一年的總死亡數,我們也可以看到臺灣已經是完勝其他國家。而且人數有多少?包括11月在內的最新數據,其實經濟學人也有這個數據、Our World in Data也有數據,6月份比平常超額了43%,癌症大概是30%,6月份可以說是多出了一個癌症的死亡率。再下來有很少嗎?沒有,17%、17%、16%就與去年雙北疫情時是一樣的。到了後面的11月其實又上來了,所以我們光是這幾個月已經累積了2萬1,039人。
這個權責都訂定得很清楚,包括中央要訂定傳染病防治政策及計畫,其中包括預防接種、檢驗及藥品,你們有哪一項準備好?你的疫苗有沒有準備好?破口又怪地方,防疫就是中央與地方的權責,但很明顯地,檢疫是中央的權責,指揮中心成立的職責就是要整合這些防疫資源,而且要做疫情資訊的研判。請問一下,昨天18個死亡病例中有幾個是先前已經公布的個案,等下看是部長或署長要回答?你每天都念這個數據,也已經念100天了,在這18個死亡病例中有幾個是先前已公布個案?為什麼會這樣?你的輕重症分流有發揮功能嗎?還是很慘!
接下來是疫苗的部分,其實緊急採購的確會有很多的授權,但是你要早一點,主要是研發與審查沒有照國際規則進行。其實我們自己的藥事法也都有研發與審查的規定,雖然有所謂的EUA,但是像美國因為3月、4月的疫情已經很嚴重,所以它在6月就公布了EUA的標準,EUA的標準都是要做第三期。如果未來已經有疫苗的話,你的對照組可以不是placebo,免疫橋接是用在這種時候,必須是有第三期,而且是以一個已有的疫苗做對照組,才會用到免疫橋接。剛剛執政黨的立委還拿那個數據給大家看,笑死人了!哪有人拿第四期來權充第三期呢?美國在2020年6月就公布了、世界衛生組織在2020年11月也公布了,將來就是要這樣看的,而我們的國家是根據什麼補助國產疫苗的研發?你沒有根據國際標準,將來一定賣不出去,賣不出去就會貴,為什麼?因為你賣不出去嘛!你要全臺灣人來扛這個成本嘛!如果依照國際標準,人家還會向你買,剛剛還提到有人阻礙我們,雖然我們不是WHO的會員國,但是疫苗的貿易是WTO、是世界貿易組織,我們是會員,請問如果真的有任何其他會員阻撓我們的疫苗,請行政機關回答我們,你們去向WTO抗議了嗎?既然你們一直說它阻撓,那麼它是會員、我們也是會員,抗議了沒有?
關於價格的部分,很快地看一下,世界衛生組織都有公布價格,我以最貴的價格讓大家比較,各國購買的價格是多少都很清楚,像哥倫比亞,它買什麼疫苗都比人家貴,都被標出來耶!就覺得這個國家有問題耶!你怎麼會什麼都比人家貴呢?那我們從這個表,你看,莫德納最貴,差不多867元,我把價格都列出來,從世界衛生組織公布的數據來看,最貴的是多少?我們買的差不多都比最貴的貴。但問題是高端你就沒有國際的可以比,你可以拿Novavax比嘛!你跟莫德納比,你高端怎麼會比莫德納還貴?你高端怎麼會比Novavax貴?比Novavax的最高價格,等於是將近它的兩倍。
再來,疫苗的價格合理性很清楚嘛!你技術是新的還是舊的?那你以前同類的疫苗,我們以前的流感疫苗,對不對?那你重組蛋白疫苗到底應該是多少錢?你政府有沒有補助?為什麼人家莫德納在美國就賣特別便宜?因為政府有補助它嘛!講好了,現在補助你,你將來做出來,第一個,你要優先供應美國;第二個,你就是要賣便宜嘛!結果它有沒有賣我們便宜呢?那你說國際打壓或競爭,美國人會打壓我們嗎?AZ英國會打壓我們嗎?
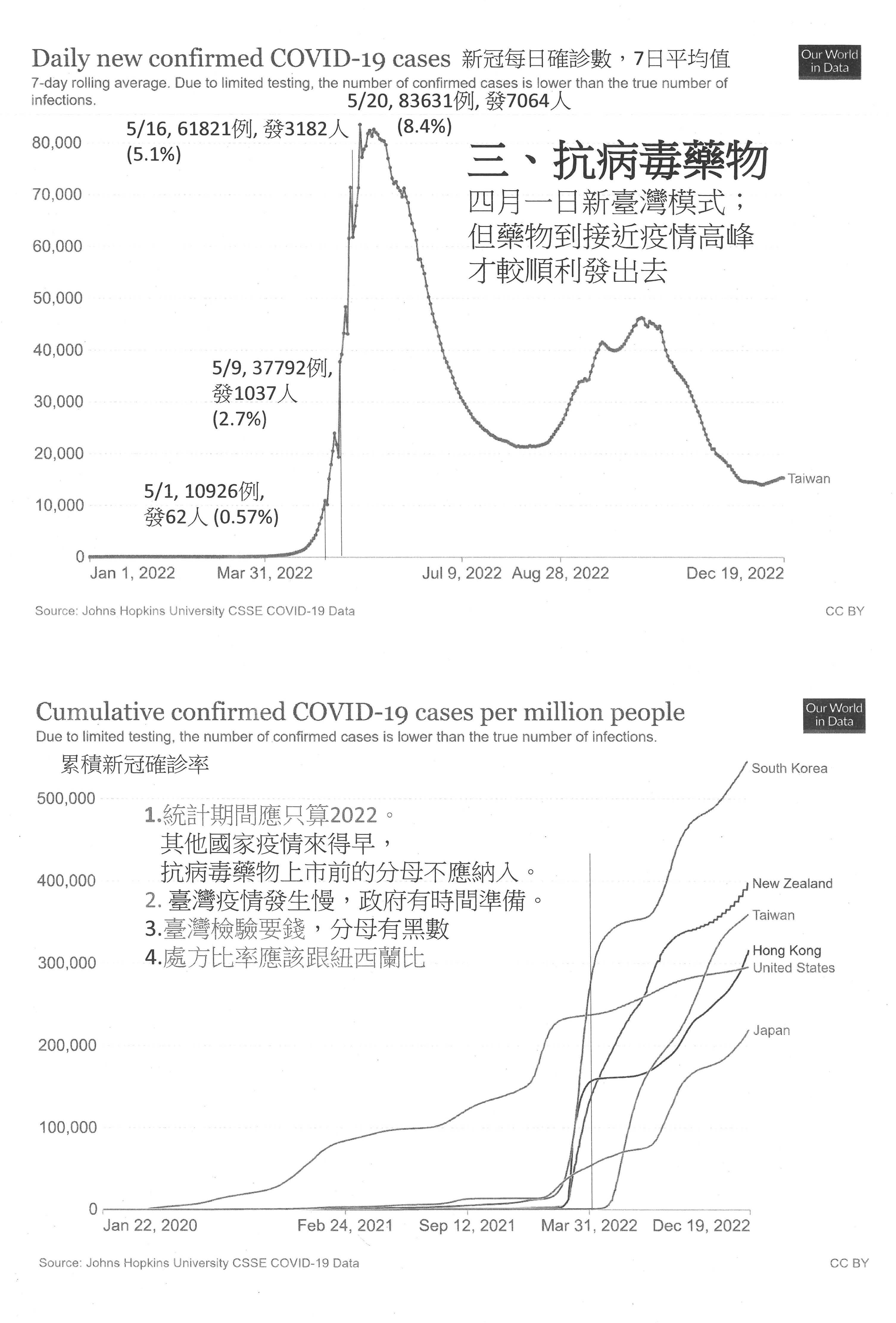
那抗病毒藥物,最後我就講到這裡,就是說它的發放一直到我們疫情高峰,疫情高峰它發到8.4%,前面疫情都已經在上升,你4月1日跟我們講新臺灣模式,你到5月1日只發出0.57%耶!可是剛剛聽基層醫療講我們就知道了嘛!你政府沒有重視基層醫療嘛!你給它綁手綁腳,你藥沒有發下去。另外,我想請教一下,行政機關告訴我們說這個藥發的比率很高,請你告訴我你的分母是什麼,你拿美國比,那你的分母是什麼?因為你應該是以2022年之後的發生人數作為分母,我是建議你們去跟紐西蘭比,你們為什麼不跟紐西蘭比呢?你們知道紐西蘭怎麼做?我們自己也都有健保資料啊!你怎麼會不知道誰是高危險群?這個事先處方箋,你還沒感染就先給你開好處方箋,萬一你感染,你拿著這個處方箋就可以去領藥,哪有等到感染再來找什麼遠距、藥在哪裡拿。
以上我做這樣的報告,我覺得依法行政非常重要,不要一直糊弄我們,到現在還在糊弄我們,我覺得人民會非常不滿,好不好?謝謝。
主席:謝謝邱淑媞教授發言。現在請薛部長就前面的委員以及專家學者的發言做回應。
請衛福部薛部長發言。
薛部長瑞元:很謝謝主席召開這一場公聽會,邀請了這麼多專家、學者來提供意見給我們,在整個防疫的過程當中,我想大家也不用太激動,有事情都可以好好來談。
針對前面幾位專家學者所提的意見,我做一個初步的回應,首先我還是必須要代表衛福部感謝第一線醫護人員的努力,如果沒有他們,疫情不可能像現在這個樣子,不論是在大醫院、在第一線照顧這些重症病人,或者是在診所幫忙後面的,剛剛邱教授所提到的,在今年開始的Omicron,我們的輕重分流事實上有90%以上都是由基層在照顧的,這樣子的模式並沒有錯,所以不要輕易去攻擊它。
第二點,剛剛醫師公會的代表都有提出莫納皮拉韋的問題,這個我們來檢討改進,讓配藥能夠更為方便,更容易取得。我想過去我們有看到日本的經驗,在日本的經驗裡面,這兩個藥進來之後,因為莫納皮拉韋的處方禁忌是比較少的,所以在日本的經驗裡面變成莫納皮拉韋用得比較多,而且量有一個比較大的懸殊。但是如同剛剛提到的,莫納皮拉韋的效果比不上Paxlovid,我們一開始比較擔心的是沒有用到比較有效的藥,所以在莫納皮拉韋的部分稍微做了一些控制,不過疫情走到現在的狀況,我們的醫療院所不管是基層還是醫院都已經非常充分瞭解這些藥物的使用方法,還有它的indication等等,我想我們應該要回過頭來尊重醫師的臨床判斷,所以這個部分的話,我可以承諾,莫納皮拉韋的配賦與使用我們會來做放寬。
第三點是有關於採購的問題,今天的提綱主要談的是採購,在採購法其實已經有相關的規定,我想前面兩位法律上面的專家也都提到了,所以採購法本身應該是沒有太大的問題,在這種特殊狀況可以做緊急採購,這個是可以容忍的,只要條件有符合。但是採購跟保密就不一樣了,剛剛有專家提到說保密30年,我想這個是錯誤的解讀,不應該再繼續傳播下去。30年是我們文件保存的期限,至於合約裡面的保密協定要求對於特定事項,包括製程、配方還有金額等資料,它的商業秘密的部分,我們有義務要保密的年限不是30年,而是不同的疫苗有各自的約定,不應該再繼續有錯誤的訊息傳播下去。
那其他的部分,包括傳染病防治法,剛剛洪委員有提到修法以及感染科醫師的部分,我想我們都會注意到,事實上是因為感染科的醫師是屬於內科的次專科,所以並不是固定的一個專科,我之前也已經交代醫事司,對於內科的部分,有一些次專科應該也要予以管制啦!以前次專科都不管的,也就是讓學會自己去發展,但是對於一些像傳染病防治法裡面要求的感染專科醫師,還有健保給付上面有特別要求的,限定某個次專科才可以做的一些procedure,或者是一些藥物的話,這一類的內科的次專科應該要列管,要不然我們沒有辦法掌握它的供需,每年應該有多少訓練出來、是不是過多還是不足,這個部分就沒有辦法去掌握,所以我們正在著手進行這件事情。
至於護理人員的護病比,這是一個長久的議題,當然我們會盡量與各界溝通,這一次沒有邀請護理人員,我想我們再跟主席去溝通,以後如果有類似的話,可能不要忘記……
主席:我沒有忘記。
薛部長瑞元:因為我們當時沒有特別去想到這件事情,這個是要抱歉的。以上我就先回應到這裡,我們的王次長會繼續留下來,最後總結的時候由他來回答,謝謝各位。
主席:洪委員,剛剛你提的,部長已經回應了。
洪委員申翰:現在都在……
主席:有、有、有,我們今天議題很多,你提的議題我們都非常注意、非常重視。
現在休息10分鐘。
休息(10時33分)
繼續開會(10時43分)
主席:現在繼續開會。
接下來請長庚大學醫務管理學系林欣柔副教授發言。
林欣柔副教授:主席、各位先進大家早安!非常謝謝立法院的邀請,來參加這次的公聽會,立法院重視防疫的檢討與作為是一件好事,因為防疫三年了,立法院的角色似乎可以更積極一些,因為在三年當中,我們只看到一個特別條例的通過,之後立法院的角色好像就比較消極一些些,所以與其說今天從學者的角度來看,我更希望從人民的角度來看,立法院應該要發揮更積極的功能與角色。特別是剛剛很多專家提到依法行政,或者是今天提綱裡面提到的權力分立,其實立法院是規劃者、立法者,行政院跟行政院下面的部門是執行者,行政權要好好地執行,也需要立法院好好地立法,所以今天其實是非常開心立法院要來盤點法制上的問題,可以讓我們提出一個好的回應的機制跟架構跟策略,下一次我們就可以做得更好。
因為受限於我的研究專長,我今天沒有辦法就所有的提綱表示意見,也受限於時間,那麼我就挑了提綱一和提綱四來跟大家分享我的想法。提綱一是有關於特別條例第七條,大家對於特七的意見已經很多了,這三年批評特七的文章已經不計其數,所以它有問題我們都知道,那簡單說它的問題在哪裡呢?它的問題就在於它是一個超越總統的緊急命令的緊急法制,換言之,跟總統的緊急命令比起來,這個特別條例的問題在於:它創造了一個不需要經過行政院會議通過也不需要再經過立法院追認的一個power、一個權力,所以這個是在法制上面,立法院創造出來的法律帶來的問題。那風險是什麼?風險就是它會破壞我們憲法上面想要節制政府權力的三權分立制度,那麼它也破壞了我們的責任政治,也會有侵害個人自由權利的風險,所以特七的問題跟風險,我想大家應該都可以很清楚地瞭解。
問題是,如果我們今天要往前走、我們要向前看,如同剛剛林靜儀委員說的,我們接下來要面臨的是更頻繁的新興傳染病威脅的時候,那我們應該要怎麼做?今天一個很大的重點其實是要來討論解方啦!討論如何解決,那麼我認為現階段我們能夠做的事情,是好好地去釐清到底什麼情形之下可以叫做緊急公共衛生事件,那構成緊急公共衛生事件的時候,政府的組織權力應該有什麼樣的調整,這個可能是我們接下來可以做的事情。所以第一個我們想要討論的就是什麼叫做緊急?因為我們的疫情和國外非常不一樣,我們看到歐美各國從三年前就一直陸陸續續發布緊急,世界衛生組織也說這是一個緊急公衛事件,那到底什麼叫緊急?我們把緊急的定義、要件想清楚了之後才能夠解決後面的問題,其實所謂的緊急指的是什麼呢?有可能包含自然災害,不僅僅是新興傳染病,也有可能是人為的攻擊,這些都可能帶來公衛上的威脅,而這樣的威脅有可能在短時間之內造成大量死亡或大量死傷,這個時候才叫做緊急,所以緊急應該包含三個很重要的要素,一個就是我們需要立即採取行動,不然會有很大程度的傷亡,而我們如果按照平常的程序是沒有辦法避免這樣的傷害的,在構成這樣的要件的情形之下,我們就會說它是一個緊急的公衛事件。
目前我們看到傳染病防治法底下,或者是特別條例底下,與國外的法制比起來的話,可能比較欠缺的是我們在事件前、事件中還有後面怎麼結束,這件事情在規範上是比較不清楚的,因為我們看到現行的傳防法,我們有成立指揮中心的機制,但是成立指揮中心之後的效果是什麼?它的權力範圍到哪裡?在指揮中心之下,人民的自由權利又如何獲得保護?這個是現在傳防法裡面比較欠缺的。其實傳防法在SARS之後經歷過很大的調整,也賦予指揮官一些特別的權力,不過我們看到傳防法還是偏重物資面,比如說他可以徵調公共場所啦!人員啦!醫院啦!然後有一些法律的排除啦!這些都偏重在財產面,所以接下來要討論的問題是:對於人的措施的部分,我們怎麼樣去調整與因應?
針對提綱四是有關於疫苗傷害補償的部分,在提綱裡面提到,我們對於緊急授權的疫苗是不是要有一個特殊的考量?這個可能是受到美國法制的影響,因為美國把VICP跟CICP分開來,把常規疫苗的補償跟緊急授權傷害補償分成兩個機制,那我們很喜歡問美國人怎麼做,也很喜歡抄美國的制度,不過我們要先知道美國人為什麼這樣做,因為從各國的法制看起來,美國就是一個例外。我們看到紐西蘭,看到瑞典,看到芬蘭,其實很多國家還是按照它原本的疫苗傷害補償制度在進行EUA的疫苗補償,那美國為什麼特別創了一個CICP呢?有兩個很重要的理由,第一,它要補償的理由跟VICP是不一樣的,在VICP的架構底下,它是針對常規的嬰幼兒疫苗,因為美國各州都強制嬰幼兒要接種,否則你不能進校園,所以在強制要求底下,國家要相對負擔一個義務去補償你的傷害。那CICP的目的是希望在緊急授權之下,大家還願意去冒險,因為這個畢竟沒有經過完整的評估流程,所以第一個是它考量的因素不一樣;第二個很重要的是,它的財源是不一樣的。美國是一個很特別的健康體系,他們沒有像我們這樣的全民健保,也沒有像歐洲各國那樣子的社會保險,他們最主要是仰賴私人的健康保險,所以VICP的錢從哪裡來呢?其實是從每一劑疫苗、買疫苗的人而來,而誰是最大的買家?是私人健康保險公司,那CICP不可能叫這些私人保險公司出錢,所以只好由聯邦預算來出錢。
可是臺灣不一樣,臺灣不管是常規疫苗或者是EUA的緊急授權疫苗,其實最大的買家都是國家,所以在財源上來考量的話,其實我們並沒有像美國這樣的條件,所以未來如果我們要採取雙軌制、要拆成兩個基金的話,基本上還是要考慮我們的審理機關、財源、要件及範圍是不是要有所不同。至於現在的VICP,我們現在有七、八千件的申請案,有大量的案件,我記得去年蔣市長在這裡也辦過一次公聽會,其實去年我就有提出建議,為了要追求效率與公平,我們可能要取捨一些東西,在制度上是不是可以用補大不補小的方式來處理?避免有很多行政的資源在處理傷害非常小的問題。還有一個就是當事人要不要有一些協力的義務來幫助這個效率更加地順暢?以上是我的報告,謝謝大家。
主席:謝謝林副教授。
接下來請胸腔重症醫師、醫學博士蘇一峰醫師發言。
蘇一峰醫師:謝謝今天有這個機會代表我們的基層醫護人員來這邊發言,我們剛才聽很多專家提到,當然提到比較多的都是一些制度面,比較少提到的是我們基層的心聲,我們今天就提一下基層的心聲。在這2年多、3年的防疫期間,我們醫護的心聲是很委屈,為什麼呢?因為從疫情一開始醫護就一直被犧牲,一直犧牲到最後,在中國武漢發生疫情之後,很快地臺灣就跟中國斷航,斷航之後做的第一件事情是什麼呢?就是限制醫護出國。我們是用哪一條法規限制醫護人員出國,到現在還是搞不清楚,美國以前有黑奴,臺灣有白奴,指的就是我們這些白色巨塔的奴隸,我們馬上被限制出國,而且拿不出任何法規。一直到最近還有不少醫院的醫護出國要先跟醫院報備才能出國,衛福部到底知不知情、指揮中心知不知道這件事情?未來要不要處理?
疫情爆發之後,不論是診所、基層醫療院所或安養院,大家開始自掏腰包買了很多防疫的重裝備,無論是兔寶寶、隔離衣、手套、口罩都自己處理,花了很多錢,結果在疫情期間,2020年有200家基層醫療院所歇業,可見我們的基層醫療院所是整個被忽略的,沒有被照顧到。當時基層醫療院所如果不小心篩出一個確診,結果得到的政府照顧是請你歇業兩週,也就是變相叫大家不要確診,我們當時也覺得這個制度非常荒謬。當時還有很多人是錢沒收到,還要自己掏腰包,健保署後來有先給我們三、四成的預付款,讓診所可以撐下去,結果年底馬上發公文叫大家還錢,不還錢的利息5%,大家有去銀行借過錢嗎?利息有到5%嗎?5%是一個高利貸,所以等於健保署在經營高利貸,對象就是我們這些白色巨塔的白奴。
我們常常聽到衛福部長講一些感謝醫護人員的話,感謝他們的辛勞,可是實際作為我們感受不到這些感謝,許多醫護人員,我今天講的不只是醫生,其實還有護理師,我們的防疫獎勵金常常都是遲發,到現在遲發半年或是9個月都是稀鬆平常的事,大家可以去各醫院問,幾乎都是遲發的狀況,甚至是扣款,半年前還有繳回的事件,錢就是給得很不甘願。甚至有一些不是大家心目中防疫的第一線人員,其實他們也是背後的無名英雄,像醫檢師、藥師,呼吸治療師也是第一線,可是他們也都在防疫條款的補償獎勵金裡面被忽視。
所謂的染疫補償是醫護人員因公、因醫療染疫的補償金,一開始大打廣告說上限35萬元,後來又開記者會把上限從30萬元提高到100萬元,但是他講的都是上限。我講一些身邊的例子,我們醫院曾經爆發急診的重症患者,因為太肥胖了需要趕快插管,插了第三次才成功,飛沫噴濺造成一些急診的醫護被感染,結果被感染的急診醫師強迫休息一個多月,拿到的補償金是6萬元。另外一位急診醫師休息兩個多月,肺部出現明顯肺纖維化,拿到的補償金是20萬元;還有一位懷孕的女護理師,在插管時不幸被感染,轉送臺大加護病房緊急剖腹生產,把小孩生出來住保溫箱,最後拿到35萬元、36萬元,大家覺得這合理嗎?雖然上限是100萬元,我們或許也可以講上限1億元,反正拿到的就是這幾十萬元,平均拿到的就是10萬元、個位數,所以我們感受不到對醫護人員的感謝,有點口惠而不實,就是沒有做到,只有嘴巴的感謝。
在疫情期間,3、4月疫情爆發的時候就開始有醫護過勞的情形,當時有病床不足、醫護人員不足的問題,而且許多北部的基層都有提出這個問題,但是指揮中心卻一直否定病床不足,到後來才承認可能有醫護不足的情形。當時基層有提出一些解方,例如用快篩代替確診,減緩急診壅塞,可是或許因為提出來的是臺北市、新北市,製造對立非常久,長達快一個月,這個政策才推行下去,讓基層醫護多辛苦一個月,讓病人多排隊一個月。其實我們是希望在疫情期間,中央與地方應該一起攜手合作,因為你們不合作,犧牲的就是醫護人員和我們的民眾。我們感謝醫護卻沒有感謝以外的實際作為,就像半年前才有醫護代表跟阿中說「我們醫務人員在疫情期間很辛苦,居然還要鋪著厚紙板在值班室地板睡覺」,阿中部長才大呼怎麼會有這件事,所以我們有時候離基層太遠了。
最後我要提的是,大家都提到我們的感染科不足,但是其實大家沒有注意到的是我們的胸腔重症醫師也不足,我們已經不足快10年了,我在104年就跟衛福部提出了,當時就是打太極回應說之後會慢慢改善,因為內專醫師會變多。但是到現在等了快10年,還是沒有改善,以前是100人,現在每年大概只有20、30人,只剩下以前的二、三成,原因是什麼?錢少、事多、離病近。以前是離監近,現在是離病近,從SARS時代到現在的COVID-19,胸腔科醫師都是在疫情第一線,而且是重症插管的第一線,這些第一線在健保體制之下並沒有得到適當的feedback,反而是被苛扣最多的項目。
我們都知道健保主導了我們的疫情防疫,這也是為什麼疫情一開始的時候,救命神器全臺大缺貨,還要靠藝人、企業募捐才有機器,背後最主要的原因是什麼?健保不給付,不給付醫院就不會買機器,所以我們健保體制下有很多很小氣的作為,讓重症醫療壓縮到極點。或許大家都不知道,重症醫療是一家醫院最賠錢的單位,越大的醫院,重症醫療的加護病房一個月可能賠個1,000萬元都不止,都要靠其他科別來補錢,賠錢的單位醫院就不給它錢,它就越來越萎縮,新的東西跟器材都買不到。健保體制有沒有考慮過這些重症醫療、呼吸重症胸腔科長期被壓制,造成人才的流失?未來如果疫情再來,我們有這麼多胸腔重症醫師嗎?不要講疫情啦!現在還有空氣污染,還有肺癌等這麼多的呼吸道問題,都需要胸腔醫師來幫忙,結果胸腔醫師每年一直減少,那我們到底處理了什麼問題?
最後再補充一個民眾的心聲,其實有很多民眾不願意打疫苗,原因是因為打疫苗的不良反應、副作用的認定太嚴格,很多人打疫苗不舒服,現在都還在排隊等認定,大概只有一成不到的人會被認定。很多人到現在等了半年以上還沒被認定到,我的很多病人也問我說他何時會被認定疫苗不良副作用,我都有幫他通報,但還沒有等到被判定,而且判定也很嚴格,所以很多人都被判定沒事,是因為自己的問題或是自己的慢性病。這樣的疫苗不良反應變得很難判定或是判定非常嚴格,也會讓民眾不信任,而不信任就不敢去打疫苗,因為打了疫苗萬一出事,自認倒楣。因此這個也是我們需要檢討的,我覺得這個很重要,我今天也特別提出來,謝謝大家。
主席(林委員為洲代):謝謝蘇一峰醫師。
接著請游委員毓蘭發言。
游委員毓蘭:今天能在這麼多專家學者前面來反映一些民意跟心聲,也請各位能夠指教。政府在COVID-19的疫苗採購上,人民要的是救命,而不是以扶植生技產業為藉口,圖利高端疫苗這些特定的廠商。包括高端疫苗的採購與審核,國內在COVID-19疫苗採購事務上,之前已經備受各界質疑,慈濟執行長顏博文揭露政府阻擋疫苗採購後,昨天鴻海創辦人郭台銘董事長也批評政府,民間購買BNT的過程經過非常艱難的障礙,是在蔡總統的恩准之下才能夠進來,同時更指出如果民間採購的疫苗能夠提早2個月進來,死亡人數可以大大的減少,指責政府並未把人民生命問題作為第一優先考量,而當初跟BNT談好的3,000萬劑疫苗,如今卻因為經費不足而有1,500萬劑無法取得,政府八千多億元的防疫紓困預算被用到哪裡去了呢?
沒有人想看見COVID-19的疫情在國內肆虐與與橫行,在政府極力宣稱有政府會做事、超前部署之際,人民卻遭遇到政府與新冠病毒的聯合凌遲,從疫情之初,人民漏夜排隊,口罩、疫苗、快篩卻付之闕如,在人民迫切需要疫苗施打時,卻出現政府為圖利特定廠商而阻擋民間的疫苗採購,在人民急需快篩來保護自己與家人的同時,政府卻又企圖核准資本額只有200萬元的小吃店,採購1,700萬劑疫苗。而在疫情期間,人民因為疫情、經濟與照顧問題的交雜,讓長照悲歌在這段時間內激增。在疫情期間,包括保險、觀光、醫護跟產業所面臨的各種困境與問題,至今卻未見政府提出任何有效的解決辦法。
更令人不滿的是,我曾經在司法及法制委員會的防疫措施法制爭議公聽會表示,這些問題在法制方面的明確性、機關權責等問題,一點都沒有改善。除了嚴重特殊傳染性肺炎防治及紓困振興特別條例的第七條,傳染病防治法第三十六條、第三十七條是經常被濫用的條文,目前法院已經有若干判決糾錯,但是權責不明確就會造成推諉卸責,比如沒收投票權就是衛福部跟中選會的互推,還有許多諸如查緝口罩、八大行業,法定權責明明是中央、地方衛政單位,卻在這種不明確的實務作法上被推給地方的警察,造成警察負擔無限增加。
對於人民所最在意的,比如親人在疫情中因為染疫往生,卻要求24小時火化的問題,我曾經就這個問題向行政院提出質詢,但是政府不管是行政院或衛福部都聲稱並沒有要求。今天凌晨我在臉書上看到李復甸教授在臉書上表示,他的恩師也是我們國內所尊敬的馬漢寶教授、馬前大法官,昨天凌晨染疫過世之後就迅速火化,我們現在到底有沒有要求確診往生者需要當天火化的規定?難道是政府說一套,底下做一套?還是政府根本就沒有把民眾在意的問題放在心上?疫情雖然已經穩定趨緩,但是並沒有完全停歇,國內因為疫情所引發關於人民、企業、產業、政府的諸多問題,也沒有真正的解決,有待執政者儘速處理。
剛剛蘇一峰醫師在這邊陳述的施打疫苗不良反應,政府的認定如此的顢頇、不清楚。我們有多少警察,我可以舉個例子,今年年初我的學生──花蓮縣政府警察局的主任秘書方世君,因為政府要求所有警察必須要打第三劑疫苗,他施打疫苗之後繼續上班,而春節前是花蓮勤務最繁重的期間,到了第3天實在是不舒服了,他自己走去慈濟醫院,第2天躺著出來,但還是被認定無法證明他的死亡跟疫苗有絕對相關。方世君他比我年輕10歲,他每天比我更注重養生、運動,政府沒有給國人一個明確的交代,我們當然不能夠接受。在此還是要向在疫情之中為保護國人身家性命、安全健康所努力的各位專家學者深深一鞠躬,謝謝你們的奉獻,謝謝。
主席:謝謝游毓蘭委員。
接著請台北市醫師公會洪德仁常務理事發言。
洪德仁常務理事:主席、各位在座的學者專家大家好,我是台北市醫師公會常務理事,也是台北市醫師公會在2020年開始就成立的COVID-19醫療緊急應變小組召集人,我等一下要報告這3年來我們所經歷的、碰到的、看到的一些問題或是狀況,某個程度也希望能夠有一些期許。
我先提出我個人的狀況,疫情指揮中心在5月下旬曾經公布一個資料,當時發現罹病的確診者死亡率在3天內占了47%,口服抗病毒藥給藥量是非常低的。以5月1日而言,當天Paxlovid只給23劑,Molnupiravir為39劑,當時的規定是所有的用藥,特別是診所的部分,要到中央指定的59家核心藥局,簡單講每個縣市只有兩家,我不知道這個核心藥局有多核心,讓這個用藥不便到極點!
我個人在5月19日確診,我符合使用用藥的條件,我的Paxlovid要請我的家人老遠到所謂的核心藥局領,我住北投區卻要到士林區領,臺北市只有兩家,另外一家是在松山區,經過大家這樣的反映之後,才有剛剛包括幾位醫師所提到的現況。也就是Paxlovid雖然已經配藥到可以提供居家照護的診所,但是Molnupiravir還是要很辛苦的到醫院領藥,或者是臺北市偷偷的試辦,每個行政區由公會和衛生局指定一個核心診所,讓我們的同儕可以就近領藥,星期假日藥局跟診所可能關門,有一些社區醫療群也跟合作的醫院協調星期假日給藥的機制。我個人很感謝振興醫院在兩個月前也跟我們訂定SOP,大概每個月星期假日,有三到五個人次的劑量可以在這個地方提領,我真的到現在還想不懂,為什麼會有這麼天才的給藥設計機制,因為疫情指揮中心一直告訴我們藥是足夠的,但是卻是拿不到的、不容易拿到的。
第二個,我要以我們在公會的COVID-19疫情小組來做報告,我們從疫情一開始就成立這樣的小組,到現在已經召開超過80場次的不定期會議,我們非常痛苦的事情是,都是我們的醫院、我們的診所跟地方的衛生局,用實體的、用線上的會議,大家反映出來的問題,能夠同舟共濟、互相協助的,以及衛生局層級可以決定的,我們就儘量去努力。譬如今年Molnupiravir的藥量當時還非常少,事實上有第一線的醫療人員,特別是女性有懷孕的狀況,當時台北市醫師公會有調查了醫師、護理師公會、藥師、中醫師等等五個醫事團體,大概有九百多劑這樣的需求,要預約、要排隊,是打不到的。幸好我們有小組的會議,當時臺北榮民總醫院告訴我們有1,200劑疫苗在他們醫院,衛生局也出席會議,我們馬上請示衛生局這批疫苗有沒有可能優先留給我們第一線防疫的醫事人員?取得衛生局的同意以後,臺北榮總馬上啟動接種,這個狀況我要報告反映的是,很多問題,包括剛剛薛部長在擔任政務次長期間,也曾經親自出席我們的防疫會議,但是後面很多相關跟中央反映聯繫的東西就變成公文的一個程序,我覺得非常遺憾。一直要到了今年4月27日中央疫情指揮中心第一次邀請全國醫師參加醫療緊急應變會議,全國各地的醫師公會理事長或代表有機會反映實際的問題,所以包括居家照護、相關服務的模式、通訊診療、快篩陽性的判定、給藥的模式才慢慢的優化。
最後我要報告的是,面對中國的疫情,我很期待我們不只是批判過去可能是失當的作為,更要精進未來防疫的相關工作,如何讓公私協力做好防疫,是我們一定要繼續努力的地方,基層、醫院跟相關的所有醫事人員,包括護理師,我們應該都是生命共同體,也期待能夠建立韌性永續的醫療政策。我一個誠摯的建議是,我們疫情指揮中心未來所謂的專家會議是不是要考慮,如果有機會邀請第一線的基層診所醫師共同參與?才有機會有接地氣的可能。有關優質的防疫政策,醫師公會其實是已經準備好了,亞太的醫師會在2021年9月的時候,我們已經公布了一個臺北宣言,也就是從基層、從分流、從我們的醫師會、從我們的政府,大家彼此要擔當的工作跟角色,我很期待這一次的經驗能夠提供給未來因應更多新興傳染性疾病,能作為一些永續的、優質的機制,以上報告。
主席:謝謝洪德仁常務理事。
請臺北市醫師職業工會會員代表陳信儒醫師發言。
陳信儒醫師:各位在座的委員、專家學者以及官員們大家好。很榮幸能夠接受這個邀請來參與這一次COVID-19疫後檢討的公聽會,臺北市職業醫師工會想要針對一些議題作出一些的意見。首先是剛才滿多人都有提到的,醫療人員在疫情剛開始的時候就有受到一些限制,不管是出國或是什麼樣相關議題,前面也有很多專家學者討論到,有人認為沒有法源依據,到後來也是有人認為那個備受爭議的第七條其實就是它的法源依據,可是有法源依據之後,又有比例原則的問題。不過在這裡醫師職業工會要特別提出來的是,其實這個問題在記者會上,有人問過指揮中心醫護人員出國禁令是否取消,那時候的回答是,其實早在2020年7月1日就已經發函取消醫療人員出國禁令,但是這裡面有提到的是,這部分比較少人注意到,其實那時候也附帶發了一個出國的規定,出國規定裡面有個但書提到「醫護人員如果出國,必須報經雇主同意的狀況之下,他就可以出國」。其實這裡就再出現了一個問題,難道我們政府對於我們特定族群基本權的干預,可以用這樣一個授權很不明確的方式,授權給醫院單位嗎?而且醫院它本身並不一定是公家醫院,像現在如果疫情趨緩了,疫情趨緩之後,這個規定其實並沒有終止,它並沒有特別的終止,它甚至不是一個法令,可是後續就發現在疫情趨緩之後,我們有部分的會員,反映他們醫院訂定許多相關的出國限制,這個出國限制的法源依據,到底是不是根據當初指揮中心訂定的這一個「醫院因應嚴重特殊傳染性肺炎(COVID-19)人員出國規定」的規定呢?如果是,事後我們醫護人員、醫療人員需要採取救濟,是要跟醫院打民事訴訟官司?還是要採取一個救濟的程序?這個部分我們想再提出來,因為其中有很多細節可以凸顯政府在干涉醫療人員的基本權方面,其實缺乏妥善的法制觀念以及一個主管機關應該負擔起的責任。我們都知道醫療人員在特殊狀況下有其公共性,有關醫療量能的部分,在某些疫情、戰爭或是災害下有其公共性,且醫療人員絕對不是自私自利、對於國家危難置身事外的。我想臺灣是一個法治國家,對於人民基本權的干預還是必須遵循法律保留原則,並符合比例原則。上述狀況我們想提出來跟主管機關做一個提醒,也希望未來如果真的有相關情事的話,可以再進行通盤考量。
另外,我們醫師職業工會也要提醒政府,臺灣的醫療人員長期籠罩在人力不足、待遇不佳的陰霾之下,剛才包括蘇醫師及其他專家學者也都有提到。在這一波疫情中能夠堅守不退,其實是醫療人員用血汗所撐出來的,就是大家說的「國際奇蹟」。而作為補償,政府在疫情初期,就端出許多相關防疫津貼政策,剛才有提到防疫津貼政策在發放過程中,其實都有部分抱怨及投訴,不管是延遲發放,還是發放金額跟當初承諾的對不起來,或是跟當初大家接收到的資訊不同。還出現補貼金額,在疫情進展過程中被下修的情況,且也沒有良好的申訴管道;甚至發生已發放津貼被追討溢發的狀況,這對於醫護人員、醫療人員在防疫作為上,都是非常傷害軍心的,也影響到政府的形象,也傷害了彼此的互信。
最近有一個新聞,有一個勞苦功高的呼吸治療師,因為COVID-19是呼吸道的疾病,相信呼吸治療師在疫情期間也是貢獻許多,他在記者會上指出,他們發現津貼金額並不符合實際照顧重症病患的數量。檢討起來,我們發現政府的津貼政策常常都是這樣在補破網,又缺乏全面通盤的規劃,並且投入審核及發放的人力資源又太少,醫院的申訴管道也形同虛設,只是徒具形式。倘若未來臺灣又再迎接一波重大事故或天災,引起醫療資源的擠壓,我們其實很難有把握,醫療人員是否會因為這波疫情以及過去的經驗,而失去對政府的信任。
作為總結,我們臺北市醫師職業工會還是要向各位說,其實在2022年疫情最高峰時,工會已經向政府清楚傳達,不要用單純的數字來自我麻醉,忽略醫療資源的不足,尤其是醫療人力的量能不足。在後疫情時代,我們要趁疫情較穩定,也趁這個議題還有討論空間時,思考儲備醫療人力的重要,我們的醫療體系常常是在上緊發條的狀態下工作,以一個特殊狀態作為平常的狀態,若不考慮在平時就改善醫療界常態性血汗醫療的勞動條件,恐怕醫療量能無法再禁起一次疫情或其他特殊狀況的考驗。以上,謝謝大家的聆聽。
主席:請邱委員泰源發言。
邱委員泰源:今天本來想要好好聆聽各位專家學者的指教,但我覺得聽了很多的建議後,我個人還是要幫人民、幫整個醫療防疫人員的努力及其後面的潛在意義,來跟大家做報告。
上個禮拜,世界醫師會的會長、理事會主席及秘書長等三位重要的領導人都到臺灣,他們長期以來都肯定臺灣醫療的表現,在座的前局長邱淑媞,以及我最好的朋友陳宜民教授,過去長期協助讓我們臺灣醫療更加亮眼,我非常感佩。他們特別提到我們臺灣的防疫其實相當好,所以他們剛好可以來也是非常幸運,同時也是各國學習的對象,並且也強調臺灣不應該被排除在WHO的相關會議之外。另外,也特別感謝總統及外交部長都來會見,跟他們進行很好的互動。
這幾年來有關COVID-19的防疫工作,真的要特別感謝行政部門同仁日以繼夜地努力,可以去看衛福部CDC幾乎到晚上都沒關燈,他們的電費可能花很多,可能要節電一下、要降低電費──這是開玩笑啦!行政部門同仁真的非常辛苦,我覺得這個部分一定要給他們掌聲鼓勵。我們的各醫事防疫團體、同仁日以繼夜地奉獻,各位不要小看剛才各位前輩所提到有關輕症的居家照顧,診所本來就很忙了,還要處理輕症病人的居家照護,可以說整晚都沒有睡,一天可能要承接幾十個個案的關懷,以上是舉例。另外,更感謝全國人民的支持及配合。
我在此也要特別說明一下,立法院不是沒有盡力,因為剛才有幾位前輩提到立法院沒有盡力。立法院從一開始的條例及預算部分,其實本席算是打頭陣的,因為我是醫師,大家就請我來提出,當然我過去也有經歷過SARS的經驗,有很多人做了很多改革,以這樣的經驗為基礎,我們就儘量將預算及條例處理好。其中,我還是要肯定很多委員非常關心防疫工作,不管是在預算審查、主決議、附帶決議方面,都儘量保障相關醫療人員、工作同仁有關勞動權益及補助的部分。當然可能不是我們說什麼,行政部門就可以照做,但立法院是一定非常努力在協助防疫,我必須站在立法院的立場跟大家報告。
因為有過SARS的經驗,以及這二十年來醫療體系及醫學教育的相關改革經驗,所以醫界也非常地提高警覺。醫師公會在109年1月8日馬上就召開防疫會議,當時就立下一個目標,不能讓任何醫護人員傷亡,更要堅守崗位,要讓所有醫療單位在崗位上守護全民的健康。當時有幾個主軸,第一個,防疫物資的整備;第二個,媒體網路的宣導;第三個,醫界應變會議;第四個,爭取獎勵方案;另外,臺灣防疫模式與國際接軌交流,有以上等幾個面向,凝聚醫界之團結及共識,協助政府守護臺灣全民生命及健康。台北市醫師公會開會都開了80次,醫師公會全聯會定期、不定期也會召開全國24縣市的會議,差不多有50次;當然各縣市至少也有50、60次以上,這都是很普遍的,所以醫界真的是非常努力。
這三年來,有三個主軸是醫界一直在做的,第一年,在防疫物資的整備是重點。跟各位報告一下,因為今天護理人員沒有來,我們覺得有點缺憾,但不要忘記,醫療是團隊,當護理人員在質疑他沒有口罩時,所有診所的院長都跟我講,今天只要有一個口罩,就是先給護理人員,而不是醫師、院長先拿,這在當時也感動我們很多護理界的朋友,所以大家更是手連手、心連心地一起打仗。第二個,第一年的重點當然是醫院及診所的防疫SOP,這個非常重要,在2月時,數以十萬計從大陸回來的臺灣人,有70%是去看社區診所,如果那一波沒有守住的話,大概是全盤皆輸,這個部分我們也要給予肯定;第二年,我們強化了分流、分級的防疫體系,同時為了減輕醫院的壓力,動員了萬名基層醫師投入社區防疫六大任務。當然那一年最重要的是疫苗的施打,我們也鼓勵診所來協助施打疫苗,醫院跟診所一起施打,六枝箭射出去,不管是社區、醫院、診所、機構甚至學校等等,全面施打疫苗,到現在臺灣接種疫苗人口有七成以上是在診所施打,螞蟻雄兵貢獻非常地多,非常感謝。第三年,在幾百萬人染疫的情況中,除了繼續發揮社區六大任務以外,特別是在幾百萬人確診的情況下,我們把它鎖在家裡,所以有輕症居家照護。
我當立委那麼多年,第一次上電臺接受訪問,因為我的口才沒有陳宜民教授那麼好,所以要客氣一點,他還說要包一個紅包給我,我回說不用,他們聽我說起我這三年醫界防疫的部分,他們非常感動,想起自己是在去醫院的時候染疫,竟然有醫師每天打電話問候他,讓他不必衝去急診,這個部分是大家過去一起努力的成果,當然我也沒有拿到紅包,所以人心安定了,也穩住了疫情的衝擊。
期間我個人要感謝的人太多了,站在醫界的立場,第一個,我要在第一時間感謝陳其邁副院長,當時我們診所買了100萬的口罩,但是廠商不發貨,因為漲價了,還漲很多,我就向陳其邁副院長求救,他當天晚上就下令馬上發貨,當時口罩都已經在貨車上,他說政府出錢,我就告訴副院長不用政府出錢,我們公會還有一點錢可以出。隔天就把口罩送到各縣市,但還是有縣市買不到,於是馬上開了24個縣市的協調會議,像新竹縣買不到口罩,我聽說林為洲委員很關心,我就把新竹市的貨調過去,隔天24個縣市的醫生全部都可以戴口罩開診,這個部分我要感謝陳其邁副院長。
第二個,過程中我們也屢次跟蔡總統反映,他真的非常關心,也親自參與全聯會的防疫會議,全聯會提了11個訴求,他一個一個的記下,也很努力想要把它解決。當然我也感謝賴副總統親自來我們公會互動好幾次,蘇院長領導的行政部門也都很誠懇、都有在努力,但因為國家資源的分配有一定的哲學,感謝他們的努力跟支持,當然最重要的還是要感謝國人的協助。
所以,今天有這個機會大家誠懇的一起檢討防疫的得失,非常的難得,對於未來強化防疫體系,我相信一定會有很大的幫助,我們也要再度肯定臺灣就是這麼地可愛、這麼地有價值,臺灣各界在面臨重大衝擊的時候,我們都能團結一致、共同解決問題,這就是我們臺灣的價值,也是我們未來可以繼續共同努力的方向,感謝大家,謝謝。
主席:請疫苗不良反應受害人暨醫院經理人陳仕津先生發言。
陳仕津先生:主席、各位先進、各位專家大家午安。去年12月15日我在這裡代表疫苗不良反應受害人陳述自己的遭遇,時隔1年,感謝委員會再邀請我來參加這個公聽會。我首先要指出的是,所有疫苗不良受害人仍然在哭泣,他們的家屬仍然在哭泣,詢問VICP案件的進度,永遠都是請等待;再來,VICP審核完了以後,絕大多數都是不予認定、跟疫苗無關、不予救濟。我個人的案件已經進入到高院訴訟了,但是大家可能不知道,在訴訟的時候,我的第一份準備狀,對造律師送過來的資料就是告訴我,依據政府資訊公開法第十八條,VICP三位委員的初步鑑定意見,怕公開委員姓名後會影響委員的公正性,所以請法院禁止我調閱我的初步鑑定意見報告。後來經由法官闡明,請VICP把委員的姓名蓋住,他們才提出這樣的報告進入法院審理,是用這樣的方式來對待一個尋求司法救濟的不良反應受害人。
今天回歸到我的報告項目,第一個,食藥署在每一批疫苗進來的時候都有一個封緘證明書,今(111)年在台積電、鴻海還有慈濟所捐贈的疫苗用完之後,當時社會在詢問下一批疫苗在哪裡?因此政府緊急採購,5月9日第一批政府採購的BNT成人及青少年疫苗抵達臺灣,5月16日完成封緘檢驗,5月23日宣布開始施打,調撥至衛生局領到疫苗的時候是5月25日。請各位看一下包裝疫苗的盒子,這些都是護理人員告訴我的事情,我在反映護理人員的問題,他們在上面看到一個粉紅色的標籤寫著「依據衛授食字第1109501216號書函」,同意將這批疫苗的冷凍保存期限從原本的7月4日直接展延到10月4日。有很多診所沒有拿到這個紙盒,因為它打的劑量少,因此拿到的是一瓶一瓶的,在瓶身上沒有看到紅色標籤,所以當天我就接到很多診所醫師的詢問電話,說看到上面冷凍保存期限是到7月4日,效期是不是到7月4日而已?我指的是瓶身,他們因為沒有紙盒,所以看不到這個粉紅色標籤,這個粉紅色標籤引發的爭議是什麼?就是為什麼在一開始封緘檢驗的時候,就直接展延它的冷凍保存期限三個月的時間?從5月25日、5月26日醫院拿到疫苗開始計算,如果到原本的期限7月4日,其實不足兩個月;依照這個粉紅色標籤延長到10月4日,仍然只有148天,冷凍保存期限不足五個月。
更好玩的是,我們甚至發現封緘總量居然有零散的尾數,這一批總共進了185萬7,372劑,每一瓶為6劑,一盒有49瓶,最後一盒居然只有29瓶,當時我們也覺得這是我們直接買人家的庫存進來使用嗎?而且是已經快要到期的庫存貨,到底是疫苗的效期比較重要,還是庫存的便宜貨比較經濟?這是我們今天要表達的問題。
回溯既往的時間,我更發現在去(110)年10月份的時候進了幾批AZ,10月4日跟10月18日各進了一批,總數量為86萬6,730劑,其中有兩個批號其有效期限是10月10日到10月31日以及10月18日到10月31日,效期只有短短的14日,這些疫苗打到人體後會產生什麼樣的情況?大家有沒有真正看過診所是怎麼去拿疫苗的?就是拿一個保溫桶裡面塞了冰寶就去領疫苗,所以疫苗運輸保存的問題非常地重要。限於時間的關係,我必須再提疫苗的包裝、劑型的繁雜與混打的問題。今天ACIP說什麼都可以混打,從腺病毒到mRNA到次世代,統統可以混打,這中間的科學依據是什麼?還有醫療院所到底有沒有資訊系統可以使用?到今天為止,從衛生局到中央,甚至到衛生所跟所有醫療院全部都在使用LINE,連視訊門診也都使用LINE,我們所有的資訊全部掌握在韓國人的手裡,這安全嗎?尤其是第一線護理人員打完疫苗的時候,他們每天都要把疫苗施打紀錄登打到NIIS系統裡面,各位知道NIIS系統多難用嗎?白天打疫苗,晚上上傳表單,得等到半夜。還有耗費醫事人力發禮券、發快篩,我親自坐在接種站,每發一份禮券要手寫一份個資,然後請民眾蓋手印,發快篩也是手寫,重新抄一次個資,再蓋一個手印,連續兩個小時,我坐在那邊這樣寫下來,手都抽筋了。何況醫護人員或其他行政人員呢?我們敢讓志工做嗎?不敢,因為少了任何一個要自掏腰包賠錢。
再來談防疫紓困補助津貼,我的書面資料有講,剛才前面也有專家提到,醫院紓困分期貸款最後被告知要還5%利息。至於水電補助,醫院都已經被清空了、降載營運了,當月水電使用最低量的時候,水電補助是惠而不實的作法。此外,防疫津貼算不清,人員都已經離職,甚至他們已經去勞工局投訴醫院。最後津貼下來,剛才部長報告是109年7月起,但是各位看,醫院收到預撥款,應於一週內核撥實際執行人員,但後來撥款是110年,中間已經差了5、6個月的時間。110年有編列防疫獎勵,111年到現在沒有編列,據說明年大家可能要慢慢等。
另外,有關疫情指揮中心,剛剛前面的專家們提到價格的問題、臨床實驗以及疫苗有效性報告的問題,還有疫苗破口──美化防疫部署、圖利執政縣市,個人覺得非常嚴重。今年5月份我們在做視訊門診,處理快篩陽即陽的事情時,新北、臺北都還在雲裡、霧裡,對不起,高雄市已經完成教育訓練,他們統統非常清楚E5200系列的所有醫事代碼是什麼,可是新北、雙北統統都不知道、看不懂。
最後我要提的是,VICP已經淪為一個附庸組織,它無視於疫苗的副作用,淡化不良反應受害者的死亡還有死亡率,推諉所有受害救濟的申請,視申請者為麻煩製造者。這個月VICP的召集人直接在媒體上告訴大家,像我這種心肌梗塞的疫苗不良受害救濟人,是絕對不可以賠償的三種典型之一,我今天自願對號入座。這就是我們的VICP,不良反應受害申請人面對的是這樣的單位,個人建議裁撤,直接重新設立新的機構。以上是個人的報告,謝謝。
主席:請疫苗不良反應受害者委任律師翁伊吟律師發言。
翁伊吟律師:主席、各位機關人員還有專家學者大家好。我是翁伊吟律師,我除了是陳先生的委任律師以外,我還是其他疫苗受害者的律師。我今天要把事實與重要資訊分享給所有人知道,讓大家知道目前有什麼問題跟缺失,也期待機關聽到之後能夠調整跟修正。
首先我們來瞭解一下疫苗緊急授權(EUA),剛剛其他學者說過,在時間有限的情況下,我來講一個重點,後續會針對現行VICP發生非常重大的問題提出說明。先講疫苗緊急授權(EUA),它具有三個特性,第一個是它具有臨時性,第二個是實驗性,第三個是不確定性。具實驗性是因為它沒有經過完整的研究、臨床製造申請等法規的流程,所以它不是那麼穩定的疫苗,相對於其他已經很成熟穩定的疫苗,它非常有實驗性質與不確定性。這個不確定性,包含對於疫苗的副作用跟不良反應完全沒有辦法瞭解得非常透澈,就像是在拼圖一樣,我們目前只知拼圖裡面的其中1塊,但是對拼圖其他99塊的內容不是那麼清楚,這就是疫苗的不確定性。如果從社會目的跟立法目的的角度切入,我們可以知道社會目的為什麼要找大家來施打疫苗?因為要防護新冠疫情,所以希望人民都來施打疫苗,產生族群免疫力,達成整體免疫。但是施打疫苗並不是所有人的身體都能夠負荷,有成千上萬的人,大家的狀況都不一樣,自然有一套社會性補償的方式,也就是施打疫苗產生不良反應之後,我們要對這些人進行特別犧牲補償,所以我們也不會去討論它的可責性。同時這個跟民事的損害賠償是不一樣的,民事是損害賠償,但這個是社會性的補償,因此我們在討論救濟的情況下,疫苗副作用是集體預防接種不可避免的代價。既然是在這種情況之下,審核只要有任何一點點沒有辦法排除與疫苗不相關,就是有關,就應該予以救濟。人民因為信賴政府說的話,所以施打了疫苗,結果發生不良反應導致疾病跟死亡,對人民來說,這個就是他的意外,而且連政府機關當時都不曉得有哪一些副作用,甚至當時連施打AZ也不曉得血小板低下症者會發生血栓。截至今日,國際醫學期刊也證明,施打AZ會發生血栓,但不見得會有血小板低下的情況,所以文獻跟資料是一步一步、一直在往前推進。在當時政府機關都不曉得有這些不良反應跟副作用的情形下,對人民來說,他們也是遇到一個意外,就是保險法上所說不可預期的意外及突發事故。
接下來我要對VICP的組織跟程序問題說明,可能會稍微有一點批評,大家就當作是一個進步的動力來思考。第一個,VICP委員背景的問題。從110年跟111年去看,大多數都是小兒科醫師,可是本次施打疫苗主要是成人,而不是兒童,所以大多由小兒科醫師審查,這個情況是有點奇怪的。第二個,它其實缺乏各類型的專家,舉例來說,陳先生今天發生的是心肌梗塞,可是整個委員會裡面,居然沒有任何一個心臟科的專家審查,這是一個很弔詭、很奇怪的事情。第三個,審議過程法律的認知不足,可能這些VICP成員不瞭解損害救濟背後的立法目的跟制度,就像我剛剛講的,它應該採取非常寬鬆的審議方式,因為它的目的是要讓這些無法確定情況的受害人有救濟的管道,而不是非常嚴格的審查,VICP可能要調整這個方向。
其次是初步鑑定意見的問題,基本上,初步鑑定意見看起來也不是由心臟科醫師撰擬,以陳先生為例,他本身是發生心肌梗塞,但是裡面根本沒有心臟科的委員。第二個,我們提起訴訟並拿初步鑑定意見來看之後發現,其實裡面根本沒有仔細寫理由或內容,只寫了兩、三行,抄了一些診斷證明書或是一些簡單的病例就說沒有關聯性,但是沒有任何的說明。
第三個是整個VICP的會議紀錄全部是空白的,什麼叫做空白?我們的個案是屬於討論的個案,可是它的會議紀錄裡面,完全沒有提到應該要怎麼去討論。其次是初步鑑定意見中,我們有一份出現無法確定關連性的,可是在這份會議紀錄裡面也是空白的,完全沒有人來做紀錄或說明。最後一個也是我覺得認為這個制度裡面最最最荒謬、最應該被修正的部分,就是所謂的共識決。沒有會議紀錄就算了,居然也沒有任何的表決過程,我們問他們怎麼作成這個決定的,他們回復叫共識決。什麼是共識決?就是之後他們想怎麼講都行,反正不需要提出任何書面資料來說明。我們就質疑怎麼可以用共識決的方式,他們就會說因為法無明文,所以他們可以這麼做,因為沒有法律規定他們必須要用按什麼程序表決、什麼程序來做紀錄。這件事情是非常荒謬的,變成起訴之後他們才去討論,想怎麼講就怎麼講,這有點像是黑箱作業,我認為這樣是非常不妥適的。
最後簡單提一點VICP和審議過程的相關問題,第一,是等待期過長;第二,是機械式審查,比如AZ,它就審查血小板低下,不會去考量其他因素;第三,當初不斷呼籲人民去施打,也呼籲慢性病者去施打,可是最後發生疾病的時候,就直接推諉到慢性病上;第四,常常慣用「潛在」一詞,我可以很肯定的是,陳先生真的沒有慢性疾病,等我們訴訟終結之後,願意的話,我們也會把資料提供給大家。他們會用「潛在」一詞來說陳先生有慢性病,甚至對造律師在開庭的時候,也說陳先生沒有慢性病但有慢性病史,這種邏輯是非常奇怪的,非常荒謬;第五,是他們會去切割病程,把所有的項目切割成一小段一小段來認定,這樣也是有問題的;第六,是倒果為因,他們不會考量受害人沒有曾經發生過疾病或相關問題,就像陳先生過去沒有任何心臟病史,他們就單純以他發病後的資料來審判,這個審定是有問題的;第七,泛綜合判斷,常常說是綜合判斷作成決定的,可是他們綜合判斷的結果並沒有提出任何醫學實證跟文獻來支持他們的理論;第八,是科學不確定性,這裡就是要講一下VICP其實在審議當時也有其侷限性,他們不瞭解實際上那99塊未知的拼圖長什麼樣子,可是如果他們不知道這99塊拼圖長什麼樣子,就應該要予以寬鬆認定,但他們不是,而是把科學不確定性的不利加諸在受害人身上,我認為這樣是不妥的。以上就是我的說明,謝謝。
主席:請台灣預防醫學學會陳宜民理事長發言。
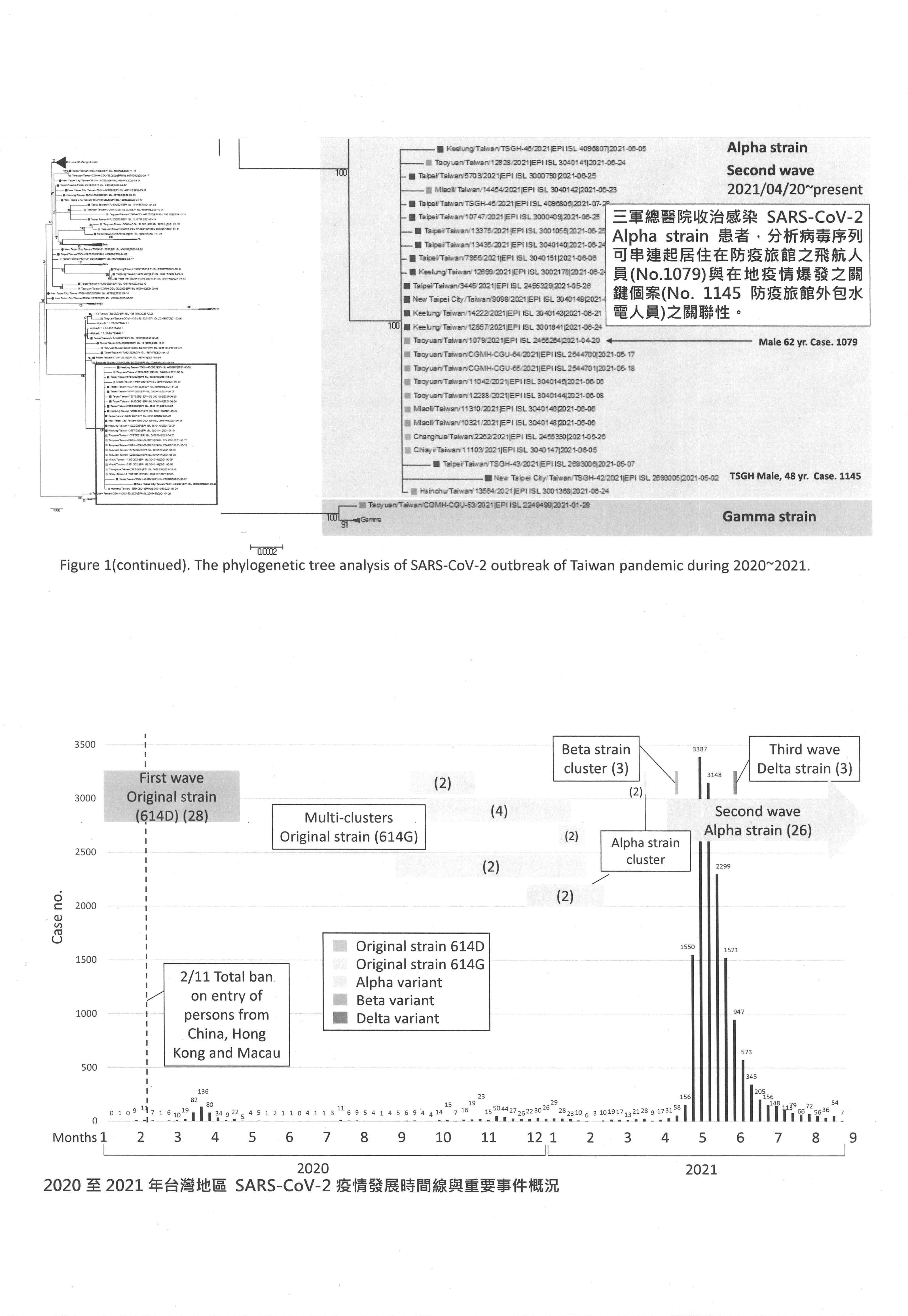
陳宜民理事長:很高興能夠來參加公聽會,我今天主要是分三個部分跟各位報告,首先在檢討回顧的部分,我先給大家看一下分子流行病學的資料,針對「3+11」這部分,我們來探討一些政策的問題;其次就是疫苗部分,大家剛剛都提到很多,就是整個疫苗政策的問題;最後再講一下篩檢的問題。
這是從過去三年COVID-19基因演化樹分析不同的變異株呈現的一個狀況,大家可以看到其實是有很多不同的變異株在流行,而且從武漢病毒株、Alpha、Beta、Delta、Gamma、Omicron這樣在流行,目前主要的流行病毒株就是BA.5。我們從2020年3月開始到現在2022年年底整個臺灣每百萬人口流行的趨勢,可以看到最近從5月開始有一波大流行,當然我們知道在整個過程中,2022年這波的流行已經有輕症化的趨勢,但是我們重點要問的是,2021年臺灣北部地區的大流行是源自哪裡?其實有點莫衷一是。很多人覺得是從桃園機場附近的諾富特防疫旅館爆發,但是也有一些人說是來自於萬華。我們先給大家複習一下,這是過去疫情指揮中心發布的案例資料,媒體也都有做了一些圖卡,大家可以看到,其實從2021年4月15日機師的防疫改成「3+11」之後,馬上就開始看到貨機機師有一些確診個案。這邊提醒一下,1078、1079定序個案是從美國回來的貨機機師,他們入住諾富特,之後就看到諾富特在5月3日有很多員工都發病了,到5月中的時候,開始陸陸續續在蘆洲跟萬華、甚至基隆出現病例,最後變成全國大流行的狀況。
我們這個研究採選的個案來自於三軍總醫院國醫中心住院的個案,總共有二十幾位病人,大部分是來自於新北跟臺北,也有基隆的病例;另外,我們在做基因演化樹分析的時候,也採用了已經上傳到資料庫的臺灣地區八十幾條基因序列,根據總共超過一百條臺灣本土的全基因COVID-19基因定序,我們畫了這個演化樹。主要我給大家看的這個方法是Maximum-liklihood,整個基因演化樹的左邊其實是非常複雜的狀況,但是我們把它放大到中間的地方,就可以看到在2020年開始的第一波、第二波流行,已經開始有一些個案是在臺北、新北跟桃園地區互相傳播的情況,之後Beta、Delta株也是一樣,都有聚集的情況。當然最重要的是從三總收治的病人裡面,我們看到個案的全基因定序,其中1079就是貨機機師感染的個案跟1145在諾富特工作、住在蘆洲的水電工,還有後來造成新北、臺北跟基隆地區大流行的,全部都是cluster,全部都是在同一個演化樹,那這個演化樹就是Alpha strain的演化樹。換句話說,由這個基因定序還有演化樹的分析,很清楚的看到他們的聚集是有意義的聚集,是100%的cluster在一起,然後很清楚看到感染的源頭是1079這個個案。在諾富特那個污染的環境中,因為監控的不良造成了餐廳員工都有感染,然後水電工在餐廳用餐,感染之後又因為地緣關係,在蘆洲造成爆發,之後大家就很清楚整個源頭。換句話說,整個臺灣在2020、2021年這幾波的流行中,從這邊蓋棺論定,就是2020、2021年的Alpha strain的流行是諾富特這邊因為「3+11」政策的問題,然後外溢出來的。
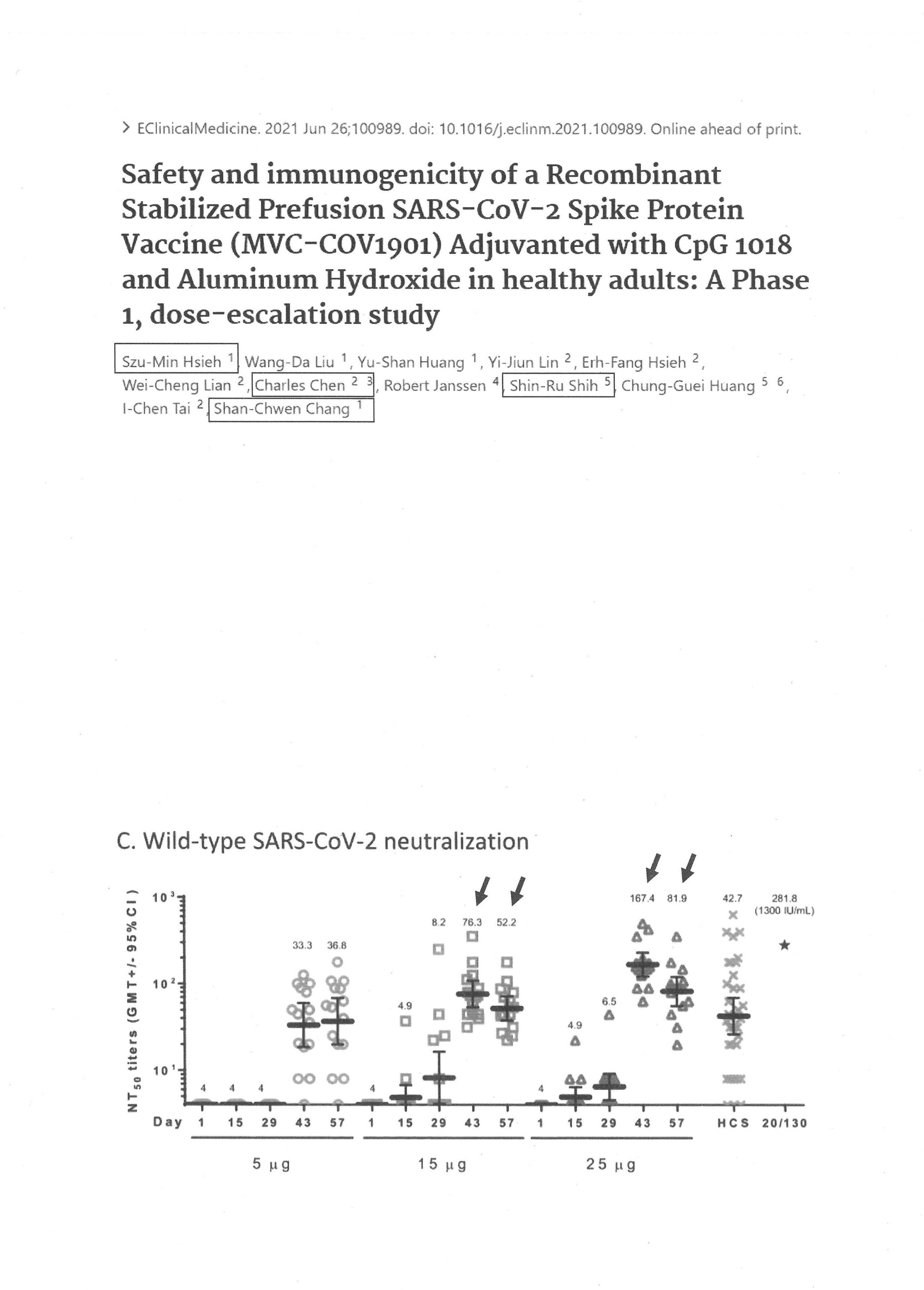
另外,我要講一下關於疫苗部分,因為我們今天是在檢討跟回顧。過去本人在國民黨智庫擔任永續發展組的召集人,所以我們總共開了30場「新冠肺炎疫苗發展的瓶頸及解決之道」座談會,如果大家有興趣,可以回頭去看,這些全部都在網站上可以看到。其中有一場我要特別提到,是在2020年7月22日,就是開始要審疫苗的時候,關於免疫橋接跟混打的問題,我要稍微講一下,因為在這場座談會裡面,我們提醒CDE官員與TFDA官員注意的就是關於國際接軌的問題,今天在場很多先進也都提到,首先就是要與國際接軌。其實剛剛在講VCIP問題時也一樣,我們覺得很重要的就是他山之石、與國際接軌,可是顯然都忽略了這個部分。我們看到的情況是國外根本沒有使用免疫橋接,無論針對新冠肺炎病毒或疫苗,都沒有依照這樣的途徑給予EUA,只有臺灣地區開始用了免疫橋接的方法,這就是為什麼要注意他山之石,一定要了解整體的國際審查情勢。當然,免疫橋接自有很多討論,大家討論的就是correlates of protection(COP),也就是哪一些免疫標記是可以與疫苗防護力劃上等號的;換句話說,如果不做三期,只做二期,並且要用免疫橋接這個方法的話,指標如果搞不定,只用一個中和性抗體視為有相當保護力,其實是不智的,也是不恰當的,現在已有很多相關資訊。當然這是事後諸葛,但我們也一樣看到了,免疫力其實就來自B cell與T cell,T cell的細胞免疫力在這次整個疫苗防護力上顯然應該扮演更重要的角色。但CDE官員在制訂辦法時其實並未要求疫苗廠必須提供這方面的資料,雖然他們可能也有做部分的資料。
另外一個問題就是疫苗選擇問題。這是已發表的論文,第一作者是臺大醫院謝思民醫師,內容是高端第一期臨床試驗的結果。我只提醒各位,在第一期結果中,總共用了3種劑量,以決定第二期要以什麼劑量為最佳劑量。所用3種劑量分別是5μg、15μg與25μg,結果大家看到什麼?高劑量的25μg打出來的疫苗效價是15μg的兩倍以上。這裡可以看到,在接種疫苗之後43天,15μg的效價只有76.3 titers,但在25μg也就是高劑量的效價是167.4 titers,足足高了兩倍。但後來做二期試驗時,大家猜猜高端採用的劑量是中劑量還是高劑量?用的是中劑量,不是用高劑量。高劑量在一期臨床試驗顯示的中和性抗體效價、也就是打出來的效果明明比較好啊!為什麼不用高劑量,要用中劑量呢?衛福部內部檢討文件裡提到了這部分,這其實是國民黨黨團提供的文件,也經過認定是從內部審查官員流出來的資料,內容顯示了是為什麼,就是因為高端疫苗在production要scaling up、也就是大量製造的時候有了瓶頸,做不出大量疫苗提供二期臨床試驗之用,所以就有這樣的compromise妥協,造成的情況則是二期臨床試驗最後不是以最佳疫苗劑量往下做,更不要說沒有做三期,只做了二期免疫橋接,用的疫苗又只有一種中和性抗體的效價,沒有與國際接軌,所以到最後疫苗賣不出去,在國外也拿不到EUA。我想這其實就是制度面需要好好檢討的,因為當初顯然就是因為TFDA與CDE官員在決定要用免疫橋接給疫苗EUA認證時缺乏仔細評估到底有沒有與國際接軌。給了EUA,一年之後要廠商提供的是保護數據,而一年後應該是今年7月要給,但是延了3個月;而且在高端給出來的結果中,在巴拉圭做了一千多人的資料,我們到現在也還沒有看到。當初給EUA時,評審委員曾要求高端必須在未來一年內再進行三期臨床試驗,而且是數千人以上的臨床試驗,以顯示它是值得被肯定的、具有效力的,但是我們還是沒有看到該資料,看到的反而是號稱CDC幫忙用大數據做出來的資料,所以陳培哲院士也批評疾管署其實不該提供這項資料,因為有利益衝突、違反公正性的問題。
最重要的是,我在此提醒公部門的人,你們如果要做這樣的事情,就應該提供這樣的資料,提出數據讓第三方公正單位、學術機構例如國衛院甚至某所國立大學深入進行double check的分析。然而這次顯然沒有,我覺得這是很嚴重的問題,就是公私不分,而且沒有讓其他人得以客觀分析。更不要說為什麼衛福部在今年4月公告可以不必用IRB、也就是不經過IRB倫理委員會的審查,可以因為公衛理由做大數據分析?而且4月公告、7月實施,代表的意思是早就已經預料到高端保護力試驗的進行情況不理想,所以要馬上動用這樣的方式,讓CDC不用經過IRB就可以直接用健保資料庫中2,300萬民眾的健保資料做這樣的分析嗎?對於這樣的情況,其實我們非常憂心,因為這牽涉到的是很多關於研究倫理的問題。
篩檢也是一個問題。本人其實在一開始就提到,我們一定要把所有子彈用出來,可是政府顯然不喜歡血清學的篩檢,甚至不喜歡抗原快篩,所以最後都要做PCR,其實有點緩不濟急,這是防疫上很嚴重的問題。如果沒有辦法早期做檢傷分類,一直有迷思想精準防疫,但精準防疫有時候就是會推拖拉,最後會造成很多延宕狀況。臺灣公衛體系其實是有防疫優勢的,資源分配與公益、城鄉差距這些問題其實都已經可以應付,因為我們已經有全民健保實施了將近30年的經驗。但是這次COVID-19其實把我們所認知的世界秩序都給打亂了,不僅是醫療層面,也包括社會、經濟、內政,其實都受到破壞。所以我建議在場每一位政治人物都應該省思,是否在危機下已扮演好你們的角色?在做決定的時候是為誰在著想?有沒有很誠實地告知人民我們要付出什麼樣的代價?現在造成的情況顯示各國防疫的通病,就是政治化、私利化、搖擺化、口水化。防疫的良方無他,其實就是尊重科學專業、放下政治口水,全民要團結抗疫、要堅定EUA的領導,生存民本優先、奉行天下為公,擱置彼此的矛盾,全球就會無縫合作。以上。謝謝。
主席:請中華民國防疫學會王任賢理事長發言。
王任賢理事長:主席、各位專家學者及在場官員大家好。我今天用很短的時間與各位談一下防疫政策總檢討。首先看防疫政策,我以前是與CDC一起打仗的人,我們打的是SARS-CoV-1。看到這次面對SARS-CoV-2,如果在實際打仗時也能做一些更好的改進,應該可以打得更優雅一點,所以我希望這次檢討CDC能夠接受,如果有機會再打SARS-CoV-3,希望能打得更好。
我們知道,防疫政策基本上分為檢疫、防疫,這次還碰到減災。檢疫,基本上是由風險族群找出病例,這是針對正常人的;防疫,是對感染病例執行隔離與治療,這是針對感染者,所以兩者是不一樣的;再來減災的話是由公衛回歸醫療,大致上是這樣。在檢疫政策上,依我們看起來,這次到底出了哪些問題?第一是我們找出病例的方法不科學。為什麼?以前我們打SARS-CoV-1時就知道了嘛!SARS-CoV-1最傷腦筋的就是我們閉著眼睛打仗,不知道病例在哪裡啊!但現在有篩查工具可檢驗,我們為什麼不用,還要閉著眼睛打?所以打起來就比較辛苦一點嘛!我不是說這樣不對,而是辛苦。所以以後如果又有,我們就不要因為會被篩查檢驗的偽陰性、偽陽性搞得一團糊就不用,沒什麼道理不用,一定要用的!沒有儘快、大量使用篩查工具真的造成很大的問題。
對於風險族群採取限制人身自由的作為,當然基本上符合傳染病防治法,傳染病防治法有這樣講的,但是有違憲之虞。雖然合法,但可能有違憲嫌疑時,會造成什麼結果?會造成民怨及官民對立,這是很不好的,到時候打起仗來會有障礙,所以要儘量合法、最好是這樣。另外一點是消耗公共衛生資源,除了消耗很多資源,基本上大部分公共衛生人力都耗在這個地方,很多該做的事情沒辦法做,這是很麻煩的。
在防疫政策方面,就是面對大量病例時,隔離政策彈性不足。我們的隔離基本上是偏重機構隔離與醫院隔離,居家隔離規劃得比較慢,轉診規劃也不完善。在機構、醫院隔離和家庭居家隔離,基本上級別最高的應該是居家隔離,因為基本上遠離大機構,隔離起來是比較容易的。但對於居家隔離的規劃不能只專注在怎麼隔離,應該研究怎麼與醫療做連接才是對的,因為病例離開了醫療機構嘛!這點非常重要。我們是有連結,可是連結中間的過程很不順暢,包括出現了重症到底怎麼監控不曉得,對不對?這時候一旦出現重症要怎麼轉到醫療院所?要用什麼車輛也不曉得,這點就比較麻煩了,所以我希望以後規劃時能規劃得更好一點。
另外,非醫療院所隔離缺乏規劃重症預警的監測。我們有很多醫療進駐,但沒有監測,病人不知道自己什麼時候算是重症,這是非常糟糕的,重症要怎麼送醫也不太清楚,以後這方面要做得更好一點。至於用檢疫場所執行隔離這點,我認為中央侵犯了地方的職權。我們知道檢疫是誰的職權?檢疫是中央的職權,但如果是隔離,隔離基本上是醫療院所要做的,而醫療院所基本上由誰主管?是地方主管。所以不應該把場所設在地方,又以檢疫為名,而不叫地方衛生單位認定這是醫院,因為這樣在將病人隔離時會出現法律上的問題。把正常人隔離在檢疫場所是可以的,但是把該隔離的人放在檢疫場所就有問題了。檢疫場所不是不能放,但要經過地方衛生主管機關認定該場所屬於醫院級別、算是醫院,也就是方艙醫院這樣的醫院,要把「醫院」這個名字放上去,所以這點我認為中央嚴重侵犯了地方的職權。應該讓地方認定嘛!你們要蓋,可以、沒有錯,但要認定出來。再者,隔離場所一定要配備醫療設備,這點非常重要,因為要把病例隔離在醫療機構裡。有病的人一定要在醫院,這是天經地義的事情;若要送到醫院之外進行隔離,醫療設備一定要進駐。
再來就是減災政策方面的缺失。減災其實很簡單,公衛與醫療要脫鉤,脫掉就可以了。但這次脫得不順,因為人經過這三年,基本上都被這些法令給限制住了,現在要一條條法律解除也解得很麻煩,要回到從前不太容易了。最好的方法就是趕快回頭下去,一回下去就好。我認為緩降是不好的,因為緩降會造成民怨,最好的作法是驟降,很快地降下去。我們知道,緩降的過程造成執政黨在這次選舉輸了,這是因為造成民怨,大家都在吵嘛!如果驟降下去,基本上不會出現這麼多問題,大家固然要適應,但可能只要適應一段短暫的時間,認知到了之後,基本上就OK了。
另外是就醫障礙未完全排除掉,到目前為止,就醫障礙還是有的,比如說還有某一部分病房要劃成專責病房,入內還要篩查。住院的人還要篩查!篩查會出什麼結果?你可能會問多篩有什麼不好呢?多篩多住啊!那病人要用的病床就不夠,問題就出來了,所以在減災過程中徒增很多超額死亡,針對這些超額死亡,我認為就是就醫障礙引起的。
再來是疫苗與抗病毒藥物的缺失。以疫苗政策的缺失來講,我認為原先的疫苗都很好,進口與本土疫苗互為犄角、互相平衡,是非常好的,結果呢?弄了抗中保臺進去以後,一切都亂掉了。以後處理疫苗就不要把抗中保臺這個東西嵌進去,這樣一切都會是非常美好的。當初如果BNT一下子都進來,不就什麼事都沒有了嗎?高端還是一樣可以賣啊!都可以啊!但政治因素一進去就完蛋了。
主動接種與按戶籍接種,應該成為疫苗普接種的重要選項。這不是說一定要這樣作,而是說既然是普接種,這種做法就要成為選項。例如有20%老人一直打不到疫苗,就是因為無法主動接種與按戶籍接種,如果能這樣做下去就會很容易。至於兒童及弱勢族群疫苗接種應該視需要以行政命令開放接種,這點很重要,政府要照顧這些人啊!要照顧這些弱勢啊!就像郭台銘一樣嘛!郭台銘的媽媽打不到BNT疫苗,那就給她嘛!買個5萬劑就好了嘛!把弱勢族群的嘴巴堵住,不就解決了嗎?不用執著還有2,000萬劑莫德納疫苗沒有打完,非得打到完:若要打完,要打好幾年啊!可能不是一、兩年打得完的。
就抗病毒藥物政策的缺失來講,就是沒有及時更新重症治療指南。什麼意思?重症治療指南是沒有藥物的、是不需要抗病毒藥物的,如果把這項指南先揭示出來,其他都好辦。如果是把藥物用在預防,預防已有預防指南,該怎麼走就怎麼走,與抗病毒藥物不要混淆了。所以我覺得重症指南要趕快公布,大概就好了。
以上就是我對防疫政策所作的建言,謝謝各位。
主席:學者專家及委員均已發言完畢,請行政機關做整體回應。
請衛福部王次長說明,時間3分鐘。
王次長必勝:主席、各位委員、各位學者專家。我代表衛福部針對今天的公聽會作回應,由於時間只有3分鐘,所以我儘快說。先謝謝立法院各位委員與專家學者給我們這麼多意見,對於沒辦法在這裡一一說明的,我們都會錄案,針對每一條澈底的檢討與討論,如果有可以改進的地方,我們會繼續做下去。
我還是做一些內容說明,在疫苗緊急採購部分,既然是法治國家,我們當然依法行政,根據與工程會的討論,用現行採購法還是足以因應相關措施,只是未來實際上要怎麼執行這一點還要再討論。另外,商業保密期限是否可以縮短、內容可不可以再縮小?這其實是滿好的方向。
我的回答順序有點亂,因為我是依專家提出的問題一一回答。關於醫院管控過嚴的問題,我們現在對社區比較鬆,對醫院比較嚴,目前是尊重醫院做法,畢竟醫院是第一線,但我們也會與醫院溝通,適當的時候還是要放寬。感染科專科醫師的培訓的確是一個問題,因為它是次專科,在醫院經營上,也許他們不具所謂的相關收益,但用這種角度考量不好,我們會好好討論這個問題。至於很多基層醫師提到抗病毒藥物,尤其是莫納皮拉韋給藥流程不順暢的問題,我們還是會定期改善檢討,一定會處理好。在防疫節奏部分,我們是以清零、提升免疫力也就是打疫苗達到共存這個節奏,目前還是以這樣的想法去做,我們認為這樣做的成效比較好。關於護理的事,今天雖然沒有找護理人員,但我們對於護理人員其實也是很關心的,也常透過工會與各醫院跟他們溝通。
剛才有專家提到為什麼不補助三期試驗,而只補助第一期與第二期?這是很好的建議,我想,應該要鼓勵廠商做三期試驗,雖然當時我們沒有足夠病例,但還是應該朝這個方向改進。關於中和抗體問題,我們之前核發EUA是根據中和抗體,至於T cell的角色,現在看起來是比較重要,這部分要有國際標準,也就是要量化、要有標準出來。剛才也有一位專家建議要開場研討會討論,我想是可行的,讓大家澈底針對這個問題討論。
雖然蘇醫師說我們只有感謝,但我還是要感謝第一線人員,至於各階段不同作為造成大家的不便,我們還是要致歉。費用部分,我想向大家說明一下,費用種類很多,有獎勵金,也有津貼。以津貼為例,我們已經發到111年10月,且對260家院所都發下去了,11月的也在進行,我們一直都在加速,對於先前有延滯情形,在此也一併致歉,我們會趕快處理掉,還有一些其他費用,我們會陸陸續續趕快處理。再來要提到一點,就是各醫院做法不同,有些醫院快一點或慢一點,這我們也會再溝通。
針對BNT次世代疫苗購買之事,這兩天我也回應很多了,我們從來沒有說不買BNT次世代疫苗,我們已在研議,但要看整體狀況,未來疫苗施打計畫也會納入。談到VICP,它是獨立設置,現在是設24名委員,上限是25名,都是依法設置,我覺得儘量不要以個案討論這個問題,這些委員都是我們請來的專家。我們不是以科別去請這些專家,而是依照他們的專長。還有,在速度部分,我們已經加速了,如果可以的話,我們會再讓速度更快一點。
也有與會者提到醫師人員出國問題。對於醫事人員出國限制,我們在2020年7月已經取消了,可能是語意上不是那麼清楚,我們會再與醫院溝通,醫院會管理自家醫院員工這是合理的,員工要請假仍要向醫院請假,只是說淮駁不是因為防疫,在語意上,我們會再講得清楚一點。會中也提到疫苗時限很短的問題,在疫苗比較缺乏的時候,我們會比較重視讓疫苗趕快進來,但也並非都不考慮疫苗效期。一開始我們核准這些疫苗是透過EUA,由於經驗不多,所以核准的效期比較短,比如說6個月,等到疫苗安全性數據出來之後,就可以申請展延,比如說從6個月展延到9個月,這種作法在各疫苗都有,也是比照歐美。有與會者提到AZ效期只有14天的狀況,那是立陶宛送給我們的疫苗,由於是人家送給我們的,可能受到一些延宕,所以效期比較短。
關於高端疫苗保護效益的問題,謝謝專家給我們很多建議。在巴拉圭的試驗數據,高端是有提供的,只是我們沒有公布給大家,需要時我們再請教他們願不願意公布,至於該疫苗其實也不是沒有做三期試驗,三期是WHO的團結試驗,我方一直到現在還沒等到這項結果,還在持續等待中。至於我們依公衛理由做大數據分析不是今年才通過,不用IRB這件事在101年7月5日,這在很久以前就公布了,我們有公文,會再提供專家參考。
我也謝謝專家提出隔離檢疫與醫療須連結的意見,我想這件事是非常重要的,包括隔離與醫療怎麼做適當的連結、用遠距夠不夠、是否有醫療進駐這些事,我們的確在這次疫情中學到很多經驗。還有,弱勢、脆弱族群疫苗之接種是否可以再aggressive一點,包括剛才所說的,是不是有點傾向適用行政法,這樣的想法值得考慮。
因為時間關係,我再重複說明,我們會把所有問題都記錄下來,好好探討。最後,我引用陳宜民教授的話,防疫還是要本於專業跟科學,以人民的福祉為出發點,避免政治口水。我們會與大家共勉,謝謝大家。
主席:謝謝衛福部的回復。
本席作以下結論:依據立法院職權行使法規定,委員會應提出公聽會報告,送交本院全體委員及出席者。公聽會報告作為審查特定議案之參考。我們會把各位的寶貴意見及書面資料彙編成冊,分送給本院全體委員以及與會政府機關代表、學者專家參閱。
今天非常感謝各位出席,並提供寶貴意見,本次公聽會到此結束,謝謝大家,現在散會。
散會(12時25分)